Fluor – Wikipedia tiếng Việt
Fluor (danh pháp cũ: flo) là một nguyên tố hóa học có ký hiệu là F và số hiệu nguyên tử là 9. Đây là halogen nhẹ nhất và tồn tại dưới dạng chất khí rất độc, màu vàng nhạt ở điều kiện tiêu chuẩn. Do có độ âm điện cao nhất, fluor hoạt động hóa học rất mạnh: phản ứng với hầu hết nguyên tố khác, bao gồm một số khí hiếm, để tạo thành hợp chất với fluor.
Trong các nguyên tố, fluor là nguyên tố phổ biến thứ 24 trong vũ trụ và thứ 13 trong lớp vỏ Trái Đất. Fluorit, nguồn khoáng vật cơ bản của fluor với tên gọi được lấy làm tên nguyên tố, được mô tả lần đầu tiên vào năm 1529; vì nó được cho thêm vào quặng kim loại để làm hạ điểm nóng chảy trong nấu luyện nên từ fluo, có nghĩa là “dòng chảy” trong tiếng Latinh, được lấy làm tên của khoáng vật này. Được cho là một nguyên tố hóa học vào năm 1810, fluor lúc bấy giờ là một chất gây nguy hiểm và khó phân lập từ các hợp chất của nó, và một số nhà khoa học thời điểm đó bị thương tật hoặc tử vong khi cố gắng thực hiện thí nghiệm này. Phải đến năm 1886, nhà hóa học người Pháp Henri Moissan mới phân lập được nguyên tố fluor qua điện phân ở nhiệt độ thấp, một quá trình vẫn còn được áp dụng trong sản xuất hiện đại. Công cuộc sản xuất khí fluor trong công nghiệp để làm giàu urani, một trong những ứng dụng lớn nhất của fluor, bắt đầu từ dự án Manhattan trong Chiến tranh thế giới thứ hai.
Do vấn đề về chi phí tinh chế fluor tinh khiết, đa số ứng dụng thương mại chủ yếu đến từ các hợp chất của nó, trong đó khoảng một nửa fluorit khai thác được sử dụng trong chế tạo thép. Lượng fluorit còn lại được chuyển thành hydro fluoride ăn mòn để sản xuất fluoride hữu cơ hoặc cryolite, chất đóng vai trò quan trọng trong quá trình luyện nhôm. Fluoride hữu cơ rất bền về mặt hóa học và nhiệt, thường được sử dụng làm chất làm lạnh, chất cách điện và trong chế tạo dụng cụ nhà bếp (dưới dạng PTFE hay Teflon). Một số dược phẩm như atorvastatin và fluoxetine cũng chứa fluor, và ion fluoride làm ức chế ổ răng, được sử dụng trong kem đánh răng và fluor hóa nước. Doanh số của các sản phẩm hóa học liên quan đến fluor ước tính khoảng hơn 15 tỷ USD mỗi năm.
Bạn đang đọc: Fluor – Wikipedia tiếng Việt
Khí fluorocarbon là loại khí nhà kính với rủi ro tiềm ẩn gây ấm lên toàn thế giới cao hơn từ 100 đến 20.000 lần so với carbon dioxide. Các hợp chất hữu cơ của fluor sống sót lâu trong môi trường tự nhiên do độ bền của link giữa carbon và fluor. Fluor không có vai trò trao đổi chất ở động vật hoang dã ; 1 số ít thực vật tổng hợp chất độc hữu cơ của nó để ngăn ngừa những loài động vật hoang dã ăn thực vật .
Phân Mục Lục Chính
- Cấu hình electron[sửa|sửa mã nguồn]
- Khả năng phản ứng[sửa|sửa mã nguồn]
- Phát hiện khởi đầu[sửa|sửa mã nguồn]
- Ứng dụng sau này[sửa|sửa mã nguồn]
- Phi kim dễ phản ứng khác[sửa|sửa mã nguồn]
- Hợp chất hữu cơ[sửa|sửa mã nguồn]
- Trong công nghiệp[sửa|sửa mã nguồn]
- Điều chế hóa học[sửa|sửa mã nguồn]
- Ứng dụng trong công nghiệp[sửa|sửa mã nguồn]
- Ứng dụng trong y tế[sửa|sửa mã nguồn]
- Vai trò sinh học[sửa|sửa mã nguồn]
- Vấn đề môi trường tự nhiên[sửa|sửa mã nguồn]
- Liên kết ngoài[sửa|sửa mã nguồn]
Cấu hình electron[sửa|sửa mã nguồn]
 Cấu trúc dạng thu gọn của nguyên tử fluor
Cấu trúc dạng thu gọn của nguyên tử fluor
Nguyên tử fluor có 9 electron, ít hơn 1 so với neon, và có cấu hình electron là 1s22s22p5: hai electron ở lớp trong đã được lấp đầy và bảy ở lớp ngoài cùng, cần thêm một electron lấp vào. Các electron ngoài cùng bị vô hiệu hóa tại lá chắn nguyên tử và có điện tích hạt nhân hữu hiệu ở mức cao, bằng 9 − 2 = 7; đặc điểm này làm ảnh hưởng đến tính chất vật lý của nguyên tử.
Năng lượng ion hóa thứ nhất của fluor cao thứ ba trong toàn bộ nguyên tố chỉ sau heli và neon, làm phức tạp thêm quy trình tách electron từ nguyên tử fluor trung hòa. Nó cũng có ái lực electron cao, đứng thứ hai chỉ sau chlor, và có xu thế lấy một electron để trở thành nguyên tử ở trạng thái vững chắc có cùng số electron với khí hiếm neon ; nó có độ âm điện cao nhất trong toàn bộ nguyên tố. [ 15 ] Nguyên tử fluor có nửa đường kính link cộng hóa trị nhỏ, khoảng chừng 60 picomet, gần bằng với hai nguyên tố lân cận trong cùng chu kỳ luân hồi là oxy và neon. [ 16 ] [ 17 ] [ gc 1 ]
Khả năng phản ứng[sửa|sửa mã nguồn]
Năng lượng link của difluor F2 nhỏ hơn rất nhiều so với Cl2 hoặc Br2 và gần bằng với link peroxide dễ gãy đôi ; đặc thù này, cùng với độ âm điện cao, là nguyên do làm fluor dễ bị phân ly, hoạt động hóa học rất mạnh, và tạo link bền với những nguyên tử nguyên tố khác. [ 19 ] trái lại, link giữa fluor với những nguyên tử khác là rất bền do nó có độ âm điện cao. Một số chất trơ như bột thép, mảnh kính, và sợi amiăng phản ứng nhanh với khí fluor lạnh ; gỗ và nước tự bốc cháy dưới tia khí fluor. [ 20 ] Phản ứng của nguyên tố fluor với sắt kẽm kim loại nhu yếu điều kiện kèm theo khác nhau. Kim loại kiềm gây nổ và sắt kẽm kim loại kiềm thổ bộc lộ phản ứng mãnh liệt ở dạng khối ; để tránh sự thụ động hóa từ việc tạo thành lớp fluoride sắt kẽm kim loại, phần đông sắt kẽm kim loại khác như nhôm và sắt phải được nghiền bột, và sắt kẽm kim loại quý cần khí fluor tinh khiết ở nhiệt độ 300 – 450 °C ( 575 – 850 °F ). Một số phi kim rắn như lưu huỳnh và phosphor phản ứng mãnh liệt trong fluor lỏng ở nhiệt độ không khí. Hydro sulfide và lưu huỳnh dioxide dễ phản ứng với fluor tạo thành hợp chất ; acid sulfuric có phản ứng ở mức độ yếu hơn nhiều, nhu yếu nhiệt độ cao .Hydro, giống như 1 số ít sắt kẽm kim loại kiềm khác, khi phản ứng với fluor sẽ gây nổ. Carbon dưới dạng muội đèn phản ứng ở nhiệt độ phòng sinh ra fluormethan. Than chì phối hợp với fluor ở nhiệt độ trên 400 °C ( 750 °F ) để tạo thành carbon monofluoride phi thức ; ở nhiệt độ cao hơn, phản ứng còn sinh ra khí fluorocarbon và đôi lúc gây nổ. [ 26 ] Carbon dioxide và carbon monoxide phản ứng ở nhiệt độ bằng hoặc cao hơn một chút ít so với nhiệt độ phòng, [ 27 ] trong khi parafin và những chất hữu cơ khác tạo phản ứng mạnh : [ 28 ] thậm chí còn, những haloalkan đã thế hết nguyên tử hydro như carbon tetrachloride, những chất thường không bắt lửa, hoàn toàn có thể tiếng nổ. [ 29 ] Mặc dù nitơ trifluoride trơ về mặt hóa học, nitơ cần được phóng điện ở nhiệt độ cao để phản ứng với fluor xảy ra do link ba rất bền trong phân tử nitơ ; amonia hoàn toàn có thể phản ứng gây nổ. [ 31 ] [ 32 ] Oxy không phối hợp với fluor ở điều kiện kèm theo môi trường tự nhiên xung quanh, nhưng hoàn toàn có thể phản ứng được khi phóng điện ở nhiệt độ và áp suất thấp ; mẫu sản phẩm tạo ra thường bị phân hủy thành những nguyên tố cấu trúc nên chúng khi đun nóng. [ 33 ] [ 35 ] Các halogen nặng hơn cũng như khí hiếm radon [ 37 ] dễ phản ứng với fluor ; trong những khí hiếm khác, chỉ có xenon và krypton là hoàn toàn có thể phản ứng được, nhưng phản ứng đó chỉ xảy ra trong điều kiện kèm theo đặc biệt quan trọng. [ 38 ]
 2 có thể theo bất kỳ góc nào. Các phân tử khác được giới hạn về mặt phẳng.Cấu trúc tinh thể của β-fluor. Hình cầu chỉ những phân tử Fcó thể theo bất kể góc nào. Các phân tử khác được số lượng giới hạn về mặt phẳng .Ở nhiệt độ phòng, fluor là một chất khí dạng phân tử hai nguyên tử ; khí fluor nguyên chất có màu vàng nhạt ( nhiều lúc còn nói là màu vàng lục ). [ 39 ] Nó có mùi hắc đặc trưng cảm nhận được ở tỷ lệ 20 ppb. Fluor ngưng tụ tạo thành chất lỏng màu vàng sáng ở − 188 °C ( − 306 °F ), là nhiệt độ chuyển tiếp gần bằng với oxy và nitơ .Fluor có hai dạng thù hình rắn là α – và β-fluor. β-fluor kết tinh ở − 220 °C ( − 364 °F ), có màu trong suốt và mềm dẻo, với cấu trúc hệ tinh thể lập phương không trật tự giống như tinh thể oxy rắn, [ gc 2 ] không giống với hệ tinh thể trực thoi trong những halogen rắn khác. [ 46 ] Khi nhiệt độ liên tục giảm xuống − 228 °C ( − 378 °F ), quy trình chuyển pha xảy ra tạo thành α-fluor rắn đục có cấu trúc hệ tinh thể đơn nghiêng với những lớp phân tử xum xê và bo góc. Quá trình chuyển pha từ β – sang α-fluor tỏa nhiệt nhiều hơn so với quy trình ngưng tụ của fluor và hoàn toàn có thể diễn ra can đảm và mạnh mẽ. [ 46 ] [ gc 3 ]
2 có thể theo bất kỳ góc nào. Các phân tử khác được giới hạn về mặt phẳng.Cấu trúc tinh thể của β-fluor. Hình cầu chỉ những phân tử Fcó thể theo bất kể góc nào. Các phân tử khác được số lượng giới hạn về mặt phẳng .Ở nhiệt độ phòng, fluor là một chất khí dạng phân tử hai nguyên tử ; khí fluor nguyên chất có màu vàng nhạt ( nhiều lúc còn nói là màu vàng lục ). [ 39 ] Nó có mùi hắc đặc trưng cảm nhận được ở tỷ lệ 20 ppb. Fluor ngưng tụ tạo thành chất lỏng màu vàng sáng ở − 188 °C ( − 306 °F ), là nhiệt độ chuyển tiếp gần bằng với oxy và nitơ .Fluor có hai dạng thù hình rắn là α – và β-fluor. β-fluor kết tinh ở − 220 °C ( − 364 °F ), có màu trong suốt và mềm dẻo, với cấu trúc hệ tinh thể lập phương không trật tự giống như tinh thể oxy rắn, [ gc 2 ] không giống với hệ tinh thể trực thoi trong những halogen rắn khác. [ 46 ] Khi nhiệt độ liên tục giảm xuống − 228 °C ( − 378 °F ), quy trình chuyển pha xảy ra tạo thành α-fluor rắn đục có cấu trúc hệ tinh thể đơn nghiêng với những lớp phân tử xum xê và bo góc. Quá trình chuyển pha từ β – sang α-fluor tỏa nhiệt nhiều hơn so với quy trình ngưng tụ của fluor và hoàn toàn có thể diễn ra can đảm và mạnh mẽ. [ 46 ] [ gc 3 ]
Đồng vị không thay đổi 19F là đồng vị duy nhất của fluor sống sót trong tự nhiên. [ 47 ] Nó có tỷ số hồi chuyển từ cao [ gc 4 ] và độ nhạy đặc biệt quan trọng với từ trường, và vì là đồng vị không thay đổi duy nhất nên nó được sử dụng trong chụp cộng hưởng từ. [ 49 ] Có 17 đồng vị phóng xạ với số khối từ 14 đến 31 đã được tổng hợp, trong đó 18F là đồng vị không thay đổi nhất với chu kỳ luân hồi bán rã là 109,77 phút. Các đồng vị phóng xạ khác có chu kỳ luân hồi bán rã dưới 70 giây ; trong đó, hầu hết bị phân rã trong vòng dưới nửa giây. [ 50 ] Hai đồng vị 17F và 18F trải qua quy trình phân rã β + và bắt giữ electron, những đồng vị nhẹ hơn phân rã qua phát xạ proton, và những đồng vị nặng hơn 19F đi qua quy trình phân rã β − ( riêng những đồng vị nặng nhất qua phát xạ neutron chậm ). [ 50 ] [ 51 ] Fluor có hai đồng phân siêu bền đã biết là 18 mF với chu kỳ luân hồi bán rã 162 ( 7 ) phần tỷ giây, và 26 mF với chu kỳ luân hồi bán rã 2,2 ( 1 ) phần nghìn giây. [ 52 ]
| Số hiệu |
Nguyên tố | Mức tương đối |
|---|---|---|
| 6 | Carbon | 4.800 |
| 7 | Nitơ | 1.500 |
| 8 | Oxy | 8.800 |
| 9 | Fluor | 1 |
| 10 | Neon | 1.400 |
| 11 | Natri | 24 |
| 12 | Magnesi | 430 |
Trong số những nguyên tố nhẹ, tỷ lệ phân bổ 400 ppb ( phần tỷ ) của fluor – đứng thứ 24 trong những nguyên tố trong ngoài hành tinh – ở mức thấp một cách không bình thường : những nguyên tố khác từ carbon đến magnesi có độ thông dụng lớn hơn từ 20 lần trở lên. [ 54 ] Đó là vì những quy trình tổng hợp hạt nhân sao đã bỏ lỡ fluor, và bất kể nguyên tử fluor nào lẽ ra được tạo nên có tiết diện hiệu dụng nguyên tử cao, được cho phép liên tục dung hợp với hydro hoặc heli để tạo thành oxy hoặc neon. [ 54 ] [ 55 ]Ngoài nguyên do về sự sống sót trong khoảng chừng thời hạn ngắn, xa hơn nữa, có ba cách lý giải được đặt ra về sự hiện hữu của fluor : [ 54 ] [ 56 ]
- trong siêu tân tinh loại II, việc các hạt neutrino bắn phá vào các nguyên tử neon làm chúng chuyển hóa thành fluor;
- gió Mặt Trời của các sao Wolf–Rayet có thể đã thổi fluor ra khỏi bất kỳ nguyên tử hydro hoặc heli nào; hoặc
- fluor bị rẽ ra trong những dòng đối lưu bắt nguồn từ sự nóng chảy trong các ngôi sao nhánh tiệm cận khổng lồ.
Fluor là nguyên tố phổ cập thứ 13 trên vỏ Trái Đất, chiếm khoảng chừng 600 – 700 ppm ( phần triệu ) về khối lượng. Nguyên tố fluor trên khí quyển Trái Đất hoàn toàn có thể phản ứng thuận tiện với hơi nước, dẫn đến nó không thông dụng trong tự nhiên ; [ 58 ] [ 59 ] nó chỉ được tìm thấy dưới dạng khoáng vật chứa fluoride, trong đó fluorit, fluorapatite và cryolite có tầm quan trọng lớn nhất trong công nghiệp. Fluorit ( CaF2 ), một khoáng vật phong phú về sắc tố và thông dụng trên quốc tế, là nguồn hầu hết dùng để sản xuất fluor ; Trung Quốc và Mexico là những nước cung ứng số 1. Hoa Kỳ từng là vương quốc đứng vị trí số 1 về chiết tách fluor vào đầu thế kỷ 20 nhưng đã chấm hết khai thác vào năm 1995. [ 61 ] [ 62 ] [ 63 ] [ 64 ] Mặc dù fluorapatite ( Ca5 ( PO4 ) 3F ) chiếm tỷ suất fluoride nhiều nhất trên toàn quốc tế, nhưng fluor chỉ chiếm 3,5 % khối lượng phân tử, nghĩa là nó phần nhiều được sử dụng dưới dạng phosphat. Tại Hoa Kỳ một lượng nhỏ hợp chất của fluor được điều chế qua acid hexafluorosilixic ( IV ), một mẫu sản phẩm phụ của công nghiệp phosphat. Cryolite ( Na3AlF6 ), một khoáng vật được sử dụng trực tiếp trong sản xuất nhôm, là loại khoáng vật giàu fluor nhất. Mỏ khai thác thương mại chính ở bờ Tây Greenland đóng cửa vào năm 1987, và hiện tại phần nhiều cryolite được sản xuất bằng chiêu thức tổng hợp .
| Các loại khoáng vật chứa fluor chủ yếu | ||

|

|

|
| Fluorit | Fluorapatite | Cryolite |
Một số khoáng vật khác như topaz có chứa fluor. Fluoride, khác với những halide khác, không tan và không sống sót ở nồng độ thích hợp trong nước muối để hoàn toàn có thể được thương mại kinh doanh hóa. Một lượng nhỏ chất hữu cơ của fluor có nguồn gốc không rõ ràng đã được phát hiện trong những vụ phun trào núi lửa và trong những suối nước nóng. Sự sống sót khí fluor trong tinh thể, dựa vào mùi của antozonite nghiền, là yếu tố còn gây tranh cãi ; [ 66 ] [ 67 ] một điều tra và nghiên cứu năm 2012 báo cáo giải trình sự sống sót của 0,04 % F2 trong antozonite về khối lượng, cho rằng những bao thể này là do bức xạ có từ sự sống sót lượng nhỏ urani. [ 67 ]
Phát hiện khởi đầu[sửa|sửa mã nguồn]
 De re metallicaTranh vẽ cảnh luyện thép trong cuốn
De re metallicaTranh vẽ cảnh luyện thép trong cuốn
Năm 1529, Georgius Agricola mô tả fluorit là một phụ gia được sử dụng để làm giảm nhiệt độ nóng chảy của kim loại trong quá trình nấu luyện.[69][gc 5] Ông dùng từ Latinh fluorés (fluo, dòng chảy) để chỉ đá fluorit. Tên này sau đó trở thành fluorspar (hiện còn được dùng phổ biến) và tiếp đến là fluorite.[61][74] Thành phần của fluorit về sau được xác định là calci fluoride.[75]
Acid hydrofluoric được sử dụng trong khắc kính từ sau năm 1720.[gc 6] Andreas Sigismund Marggraf lần đầu tiên xác định được đặc tính của hợp chất này vào năm 1764 khi đun nóng fluorit với acid sulfuric, và dung dịch thu được làm ăn mòn bình thủy tinh chứa nó.[77][78] Nhà hóa học người Thụy Điển Carl Wilhelm Scheele lặp lại thí nghiệm này vào năm 1771 và gọi tên sản phẩm thu được là fluss-spats-syran (hay fluorspar acid trong tiếng Anh).[78][79] Năm 1810, nhà vật lý người Pháp André-Marie Ampère đặt giả thiết rằng hydro và một nguyên tố tương tự với chlor tạo nên acid hydrofluoric.[80] Ba năm sau, Sir Humphry Davy đề xuất gọi tên nguyên tố đó là fluorine từ tên tiếng Anh fluoric acid và hậu tố -ine của các halogen khác, dựa trên tên gọi do Ampère đặt ra trong thư gửi ông vào ngày 26 tháng 8 năm 1812.[81][83] Từ này được sử dụng trong nhiều ngôn ngữ châu Âu; tiếng Hy Lạp, tiếng Nga, và một số ngôn ngữ khác (sau giả thiết của Ampère) sử dụng tên ftor hoặc các tên gọi dẫn xuất của nó, bắt nguồn từ từ φθόριος (phthorios, phá hủy). Từ fluorum trong tiếng Latinh hiện đại đã dẫn đến ký hiệu nguyên tố là F như hiện tại; ký hiệu Fl từng xuất hiện trong các tài liệu trước đây.[85][gc 7]
Các nghiên cứu và điều tra khởi đầu về fluor nguy khốn đến mức 1 số ít nhà thí nghiệm thế kỷ 19 được gọi là ” nhà tử đạo fluor ” sau khi gặp điều không may với acid hydrofluoric. [ gc 8 ] Việc phân lập nguyên tố fluor gặp trở ngại bởi tính ăn mòn cực mạnh của chính nguyên tố đó và hydro fluoride, cũng như việc thiếu đi một chất điện ly đơn thuần và thích hợp. [ 75 ] [ 86 ] Edmond Frémy đặt giả thuyết rằng việc điện phân hydro fluoride tinh khiết để sinh ra fluor là điều khả thi và nghĩ ra một chiêu thức để tạo ra những mẫu khan từ kali bifluoride đã acid hóa ; nhưng thay vào đó, ông phát hiện khí hydro fluoride ( khô ) thu được không dẫn điện. [ 75 ] [ 86 ] [ 87 ] Henri Moissan, một cựu học trò của Frémy, giữ kiên trì và sau nhiều lần thử và sai thì phát hiện ra rằng hỗn hợp kali hydrofluoride và hydro fluoride khô có tính dẫn điện, được cho phép quy trình điện phân được diễn ra. Để chống lại tính ăn mòn nhanh của bạch kim trong pin điện hóa, ông làm lạnh phản ứng đến nhiệt độ cực thấp trong một bình chứa đặc biệt quan trọng và sản xuất pin từ hỗn hợp bạch kim và iridi có sức chống chịu cao hơn, đồng thời sử dụng nút bít fluorit. [ 86 ] Năm 1886, sau 74 năm nỗ lực của nhiều nhà hóa học, Moissan phân lập thành công xuất sắc nguyên tố fluor. [ 87 ] [ 89 ]Năm 1906, hai tháng trước khi qua đời, Moissan được trao giải Nobel Hóa học, [ 90 ] với lời tuyên dương rằng để : [ 86 ]
công nhận những điều có ích mà ông đã làm nên trong quy trình điều tra và nghiên cứu và phân lập nguyên tố fluor … Cả quốc tế đã ngưỡng mộ trước kỹ năng và kiến thức thí nghiệm tuyệt vời mà từ đó, [ ông ] đã khám phá được ” con thú dữ ” trong toàn bộ những nguyên tố. [ gc 9 ]
Tranh vẽ dụng cụ thí
nghiệm của Moissan (1887) Chân dung Henri Moissan
Chân dung Henri Moissan
Ứng dụng sau này[sửa|sửa mã nguồn]
Công ty con Frigidaire của General Motors ( GM ) thực thi những thí nghiệm với chất làm lạnh chlorofluorocarbon vào cuối thập niên 1920, và Kinetic Chemicals được xây dựng dưới sự hợp tác liên kết kinh doanh giữa GM và DuPont vào năm 1930 với kỳ vọng tiếp thị Freon-12 ( CCl2F2 ) trở thành một chất làm lạnh như vậy. Nó dần thay thế sửa chữa những hợp chất cũ và ô nhiễm trước đây, làm tăng nhu yếu sử dụng tủ lạnh trong phòng bếp, và trở thành mẫu sản phẩm sinh lời ; đến năm 1949 DuPont đã mua lại Kinetic và tiếp thị một số ít hợp chất Freon khác. [ 78 ] [ 91 ] [ 93 ] Polytetrafluoroethylen ( Teflon ) được Roy J. Plunkett tìm ra một cách vô tình vào năm 1938 khi nghiên cứu và điều tra về tủ lạnh tại Kinetic, và tính trơ mạnh về mặt hóa học và về nhiệt của nó góp thêm phần làm tăng cường việc kinh doanh thương mại hóa và sản xuất đại trà phổ thông đến năm 1941. [ 78 ] [ 91 ]Nguyên tố fluor mở màn được sản xuất hàng loạt trong Chiến tranh quốc tế thứ hai. Đức vận dụng chiêu thức điện phân ở nhiệt độ cao để sản xuất hàng tấn chlor trifluoride gây cháy theo kế hoạch [ 94 ] và Dự án Manhattan sử dụng lượng lớn cho sản xuất urani ( VI ) fluoride để làm giàu urani. Vì UF6 có tính ăn mòn giống fluor, những xí nghiệp sản xuất khuếch tán dạng thể khí cần những loại nguyên vật liệu đặc biệt quan trọng : nickel dùng làm màng, fluoropolyme làm lớp cản, và fluorocarbon lỏng làm chất làm lạnh và chất bôi trơn. Ngành công nghiệp hạt nhân đang tăng trưởng nhanh gọn này về sau đã giúp tăng cường sự tăng trưởng của ngành hóa học fluor sau cuộc chiến tranh. [ 95 ]
Số lượng hợp chất hóa học tương quan đến fluor là rất lớn, gồm có cả khoanh vùng phạm vi hữu cơ và vô cơ. Fluor tích hợp được với sắt kẽm kim loại, phi kim, á kim và phần đông khí hiếm, [ 96 ] và thường có trạng thái oxy hóa là − 1 trong những hợp chất này. [ gc 10 ] Ái lực electron cao của fluor dẫn đến ưu tiên về link ion : khi nó tạo thành link cộng hóa trị, chúng là những link có cực và gần như luôn luôn là link đơn. [ 99 ] [ 100 ] [ gc 11 ]
Kim loại kiềm tạo thành muối ion monofluoride và dễ tan ; chúng có cấu trúc dạng lập phương như natri chloride và những muối chloride tựa như. [ 101 ] Muối difluoride của sắt kẽm kim loại kiềm thổ chứa những link ion mạnh nhưng không tan trong nước, [ 85 ] ngoại trừ beryli fluoride, một chất biểu lộ một số ít đặc trưng cộng hóa trị và có cấu trúc giống với thạch anh. [ 103 ] Đất hiếm và nhiều sắt kẽm kim loại khác tạo thành muối trifluoride, hầu hết trong đó là muối ion. [ 105 ] [ 106 ]Liên kết cộng hóa trị dễ thấy rõ thứ nhất là ở muối tetrafluoride : muối của zirconi, hafni [ 107 ] [ 108 ] và một số nguyên tố họ Actini [ 109 ] là muối ion với nhiệt độ nóng chảy cao, [ gc 12 ] trong khi muối của titani, vanadi, [ 114 ] và niobi là muối trùng hợp, nóng chảy hoặc phân hủy ở nhiệt độ không quá 350 °C ( 660 °F ). Muối pentafluoride liên tục khuynh hướng này với những polyme nằm theo đường thẳng và phức hệ oligome. Có 13 muối hexafluoride sắt kẽm kim loại đã biết, [ gc 13 ] tổng thể đều có dạng bát diện, và hầu hết chúng là chất rắn dễ bay hơi ngoại trừ chất lỏng MoF6 và ReF6, và chất khí WF6. [ 122 ] Rheni ( VII ) fluoride, muối heptafluoride sắt kẽm kim loại duy nhất được diễn đạt rõ ràng, là một chất rắn phân tử nóng chảy chậm có dạng hình học phân tử tháp đôi năm cạnh. Muối fluoride sắt kẽm kim loại với nhiều nguyên tử fluor hơn có năng lực phản ứng đặc biệt quan trọng cao. [ 124 ]
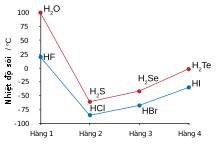 Biểu đồ điểm sôi của những hydro halide và chalcogenide, cho thấy những giá trị cao không bình thường so với hydro fluoride và nước
Biểu đồ điểm sôi của những hydro halide và chalcogenide, cho thấy những giá trị cao không bình thường so với hydro fluoride và nước
Hydro kết hợp với fluor để tạo thành hydro fluoride, trong đó các phân tử rời rạc tập trung thành cụm bằng liên kết hydro, tương đồng với nước hơn hydro chloride.[125][126][127] Nó sôi tại nhiệt độ cao hơn nhiều so với các hydro halide nặng hơn và bị trộn lẫn hoàn toàn với nước, khác với các hydro halide này. Hydro fluoride dễ bị hydrat hóa khi tiếp xúc với nước để tạo thành dung dịch hydro fluoride, hay còn gọi là acid hydrofluoric. Không giống các acid hydrohalic khác, vốn đều là acid mạnh, acid hydrofluoric là một acid yếu ở nồng độ thấp,[gc 14] có hằng số điện ly acid pKa bằng 3,17 ở 25 °C.[131] Tuy nhiên, nó có thể làm ăn mòn thủy tinh, điều mà các acid khác không thể làm được.[132]
Phi kim dễ phản ứng khác[sửa|sửa mã nguồn]
- Á kim cũng được xét trong phần này
 Chlor trifluoride, một chất gây ăn mòn làm bắt lửa amiăng, bê tông, cát và các chất chống cháy khácHợp chất fluoride hai nguyên tố của á kim và phi kim khối p thường là hợp chất cộng hóa trị và dễ bay hơi, với năng lực phản ứng khác nhau. Phi kim chu kỳ luân hồi 3 trở về sau hoàn toàn có thể tạo thành hợp chất fluoride siêu hóa trị. [ 134 ]Bor trifluoride có dạng phẳng và chứa một bát tử chưa hoàn hảo. Nó hoạt động hóa học như một acid Lewis và tích hợp với base Lewis như amonia để tạo thành mẫu sản phẩm cộng. [ 135 ] Carbon tetrafluoride có dạng tứ diện và là chất trơ ; [ gc 15 ] những hợp chất cùng nhóm với nó, silic và germani tetrafluoride, cũng có dạng tứ diện [ 136 ] nhưng hoạt động giải trí giống một acid Lewis. Các nguyên tố nhóm nitơ tạo thành hợp chất trifluoride có năng lực phản ứng và tính base tăng dần khi khối lượng mol càng lớn, mặc dầu nitơ trifluoride chống lại sự thủy phân và không có tính base. [ 139 ] Hợp chất pentafluoride của phosphor, asen, và antimon có năng lực phản ứng lớn hơn so với hợp chất trifluoride tương ứng, trong đó antimon pentafluoride là acid Lewis trung tính mạnh nhất đã biết. [ 140 ]Hợp chất fluoride của những nguyên tố nhóm chalcogen gồm nhiều loại khác nhau : hợp chất difluoride không bền sống sót so với oxy ( hợp chất duy nhất đã biết mà trong đó oxy có trạng thái oxy hóa + 2 ), lưu huỳnh, và selen. Hợp chất tetrafluoride và hexafluoride của lưu huỳnh, selen và telu cũng sống sót ; đó là hợp chất bền do có nhiều nguyên tử fluor hơn và những nguyên tử TT nhẹ hơn, nên lưu huỳnh hexafluoride là chất đặc biệt quan trọng trơ về mặt hóa học. [ 142 ] Chlor, brom và iod hoàn toàn có thể tạo thành những hợp chất mono -, tri – và pentafluoride, nhưng chỉ có iod heptafluoride là xác lập được đặc tính trong số những hợp chất heptafluoride của hợp chất halogen hoàn toàn có thể có. Nhiều loại hợp chất trong số này là nguồn chính tạo ra nguyên tử fluor và những hoạt động giải trí công nghiệp sử dụng chlor trifluoride nhu yếu giải pháp phòng ngừa tai nạn đáng tiếc tựa như như khi sử dụng fluor. [ 146 ]
Chlor trifluoride, một chất gây ăn mòn làm bắt lửa amiăng, bê tông, cát và các chất chống cháy khácHợp chất fluoride hai nguyên tố của á kim và phi kim khối p thường là hợp chất cộng hóa trị và dễ bay hơi, với năng lực phản ứng khác nhau. Phi kim chu kỳ luân hồi 3 trở về sau hoàn toàn có thể tạo thành hợp chất fluoride siêu hóa trị. [ 134 ]Bor trifluoride có dạng phẳng và chứa một bát tử chưa hoàn hảo. Nó hoạt động hóa học như một acid Lewis và tích hợp với base Lewis như amonia để tạo thành mẫu sản phẩm cộng. [ 135 ] Carbon tetrafluoride có dạng tứ diện và là chất trơ ; [ gc 15 ] những hợp chất cùng nhóm với nó, silic và germani tetrafluoride, cũng có dạng tứ diện [ 136 ] nhưng hoạt động giải trí giống một acid Lewis. Các nguyên tố nhóm nitơ tạo thành hợp chất trifluoride có năng lực phản ứng và tính base tăng dần khi khối lượng mol càng lớn, mặc dầu nitơ trifluoride chống lại sự thủy phân và không có tính base. [ 139 ] Hợp chất pentafluoride của phosphor, asen, và antimon có năng lực phản ứng lớn hơn so với hợp chất trifluoride tương ứng, trong đó antimon pentafluoride là acid Lewis trung tính mạnh nhất đã biết. [ 140 ]Hợp chất fluoride của những nguyên tố nhóm chalcogen gồm nhiều loại khác nhau : hợp chất difluoride không bền sống sót so với oxy ( hợp chất duy nhất đã biết mà trong đó oxy có trạng thái oxy hóa + 2 ), lưu huỳnh, và selen. Hợp chất tetrafluoride và hexafluoride của lưu huỳnh, selen và telu cũng sống sót ; đó là hợp chất bền do có nhiều nguyên tử fluor hơn và những nguyên tử TT nhẹ hơn, nên lưu huỳnh hexafluoride là chất đặc biệt quan trọng trơ về mặt hóa học. [ 142 ] Chlor, brom và iod hoàn toàn có thể tạo thành những hợp chất mono -, tri – và pentafluoride, nhưng chỉ có iod heptafluoride là xác lập được đặc tính trong số những hợp chất heptafluoride của hợp chất halogen hoàn toàn có thể có. Nhiều loại hợp chất trong số này là nguồn chính tạo ra nguyên tử fluor và những hoạt động giải trí công nghiệp sử dụng chlor trifluoride nhu yếu giải pháp phòng ngừa tai nạn đáng tiếc tựa như như khi sử dụng fluor. [ 146 ]
 Ảnh chụp những tinh thể xenon tetrafluoride ( năm 1962 ). Việc tổng hợp được hợp chất này cùng với xenon hexafluoroplatinat đã làm giật mình nhiều nhà hóa học .Khí hiếm, những nguyên tố có những lớp electron hoàn hảo, không có phản ứng nào với những nguyên tố hóa học khác cho đến năm 1962 khi Neil Bartlett phát hiện và tổng hợp được xenon hexafluoroplatinat ; xenon difluoride, tetrafluoride, hexafluoride, và nhiều hợp chất oxyfluoride đã được phân lập thành công xuất sắc kể từ đó. Trong những khí hiếm khác, krypton tạo thành muối difluoride, và radon phản ứng với fluor để tạo thành một chất rắn được cho là radon difluoride. [ 151 ] Muối fluoride hai nguyên tố của những khí hiếm nhẹ hơn là loại muối không bền riêng biệt : argon và hydro fluoride phối hợp với nhau trong điều kiện kèm theo vô cùng đặc biệt quan trọng để sinh ra argon fluorohydride. [ 38 ] Không có muối fluoride nào của heli và neon sống sót lâu, [ 153 ] và chưa có muối neon fluoride nào từng được quan sát ; heli fluorohydride được ghi nhận là hoàn toàn có thể thấy được trong vòng vài phần nghìn giây ở áp suất cao và nhiệt độ thấp. [ 153 ]
Ảnh chụp những tinh thể xenon tetrafluoride ( năm 1962 ). Việc tổng hợp được hợp chất này cùng với xenon hexafluoroplatinat đã làm giật mình nhiều nhà hóa học .Khí hiếm, những nguyên tố có những lớp electron hoàn hảo, không có phản ứng nào với những nguyên tố hóa học khác cho đến năm 1962 khi Neil Bartlett phát hiện và tổng hợp được xenon hexafluoroplatinat ; xenon difluoride, tetrafluoride, hexafluoride, và nhiều hợp chất oxyfluoride đã được phân lập thành công xuất sắc kể từ đó. Trong những khí hiếm khác, krypton tạo thành muối difluoride, và radon phản ứng với fluor để tạo thành một chất rắn được cho là radon difluoride. [ 151 ] Muối fluoride hai nguyên tố của những khí hiếm nhẹ hơn là loại muối không bền riêng biệt : argon và hydro fluoride phối hợp với nhau trong điều kiện kèm theo vô cùng đặc biệt quan trọng để sinh ra argon fluorohydride. [ 38 ] Không có muối fluoride nào của heli và neon sống sót lâu, [ 153 ] và chưa có muối neon fluoride nào từng được quan sát ; heli fluorohydride được ghi nhận là hoàn toàn có thể thấy được trong vòng vài phần nghìn giây ở áp suất cao và nhiệt độ thấp. [ 153 ]
Hợp chất hữu cơ[sửa|sửa mã nguồn]

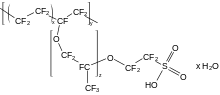 Cấu trúc hóa học của Nafion, một loại fluoropolyme sử dụng trong pin nguyên vật liệu và nhiều ứng dụng khácLiên kết carbon − fluor là link mạnh nhất trong hóa hữu cơ, [ 156 ] và làm cho những hợp chất hữu cơ của fluor có tính bền. Nó gần như không sống sót trong tự nhiên, nhưng có trong những hợp chất tổng hợp. Các nghiên cứu và điều tra trong nghành này thường được thôi thúc bởi những ứng dụng trong sản xuất thương mại ; [ 158 ] những hợp chất tương quan rất phong phú và phản ánh độ phức tạp vốn có trong hóa hữu cơ. [ 91 ]
Cấu trúc hóa học của Nafion, một loại fluoropolyme sử dụng trong pin nguyên vật liệu và nhiều ứng dụng khácLiên kết carbon − fluor là link mạnh nhất trong hóa hữu cơ, [ 156 ] và làm cho những hợp chất hữu cơ của fluor có tính bền. Nó gần như không sống sót trong tự nhiên, nhưng có trong những hợp chất tổng hợp. Các nghiên cứu và điều tra trong nghành này thường được thôi thúc bởi những ứng dụng trong sản xuất thương mại ; [ 158 ] những hợp chất tương quan rất phong phú và phản ánh độ phức tạp vốn có trong hóa hữu cơ. [ 91 ]
Phân tử rời rạc[sửa|sửa mã nguồn]
Sự thay thế sửa chữa liên tục nguyên tử hydro trong một alkane bằng nguyên tử fluor làm biến hóa đặc thù hóa học của nó một cách từ từ : điểm nóng chảy và điểm sôi giảm xuống, khối lượng riêng tăng lên, tính tan trong hydrocarbon giảm và tính bền toàn diện và tổng thể tăng. Perfluorocarbon, [ gc 16 ] những chất trong đó những nguyên tử hydro bị thay thế sửa chữa hết, không tan trong phần đông dung môi hữu cơ, chỉ xảy ra phản ứng với natri trong amonia lỏng ở điều kiện kèm theo xung quanh .
Thuật ngữ hợp chất perfluor hóa được dùng cho những hợp chất vốn có thể là perfluorocarbon nếu không phải do sự xuất hiện của một nhóm chức,[160][gc 17] thường là acid carboxylic. Các hợp chất này cũng có nhiều tính chất tương tự như perfluorocarbon, chẳng hạn như tính bền và tính kỵ nước,[162] trong khi nhóm chức làm tăng khả năng phản ứng của chúng, cho phép chúng bám vào bề mặt hoặc trở thành chất hoạt động bề mặt;[163] đặc biệt, chất hoạt động bề mặt fluor hóa có thể làm giảm sức căng bề mặt của nước nhiều hơn so với các đồng đẳng gốc hydrocarbon của chúng. Fluorotelome, những chất có một vài nguyên tử carbon chưa bị fluor hóa gần nhóm chức, cũng được xem là hợp chất perfluor hóa.[162]
Polyme cũng bộc lộ tính bền tăng dần do sự sửa chữa thay thế nguyên tử hydro bằng fluor trong những phân tử rời rạc ; điểm nóng chảy của chúng cũng thường tăng lên như vậy. Polytetrafluoroethylen ( PTFE ), loại fluoropolyme đơn thuần nhất và là đồng đẳng perfluoro của polyethylene với đơn vị chức năng cấu trúc là – CF2 –, bộc lộ sự đổi khác này theo Dự kiến, nhưng điểm nóng chảy rất cao của nó làm nó khó hoàn toàn có thể được dập khuôn. Một số dẫn xuất PTFE chịu được nhiệt độ thấp hơn nhưng dễ dập khuôn hơn : nhựa FEP thay một số ít nguyên tử fluor bằng nhóm trifluorometyl, nhựa PFA làm tựa như với nhóm trifluoromethoxy, và Nafion chứa những xích bên perfluoroete kết thúc bằng nhóm acid sulfonic. [ 166 ] [ 167 ] Một số fluoropolyme khác vẫn giữ lại một vài nguyên tử hydro ; polyvinylidene fluoride chứa lượng nguyên tử fluor bằng 50% của PTFE và polyvinyl fluoride chứa lượng bằng một phần tư, nhưng cả hai đều có đặc thù giống polyme perfluor hóa .
Trong công nghiệp[sửa|sửa mã nguồn]
 AnhPhòng chứa fluor công nghiệp ở thành phố Preston, hạt Lancashire
AnhPhòng chứa fluor công nghiệp ở thành phố Preston, hạt Lancashire
Phương pháp của Moissan được áp dụng để sản xuất fluor trong công nghiệp, thông qua điện phân hỗn hợp kali fluoride/hydro fluoride: các ion hydro và ion fluoride được khử và oxy hóa tại một thùng chứa bằng thép làm cathode và một khối carbon làm anode dưới dòng điện 8–12 vôn để tạo ra khí hydro và khí fluor.[62] Nhiệt độ sau đó được tăng lên, KF•2HF nóng chảy ở 70 °C (158 °F) và được điện phân ở 70–130 °C (158–266 °F). KF, chất dùng làm xúc tác, là cần thiết vì HF tinh khiết không thể điện phân được.[78] Fluor có thể được cất trữ trong trụ thép có phần bên trong được thụ động hóa, ở nhiệt độ dưới 200 °C (392 °F); nếu không thì có thể dùng nickel.[78] Van điều chỉnh và đường ống được làm bằng nickel; riêng đường ống thay vào đó có thể làm bằng Monel. Việc thụ động hóa thường xuyên cũng như ngăn nước và dầu mỡ phải được thực hiện. Trong phòng thí nghiệm, dụng cụ thủy tinh có thể trữ được khí fluor ở áp suất thấp và điều kiện không có nước; một số tài liệu thay vào đó khuyến cáo sử dụng hệ thống nickel-Monel-PTFE.[173]
Điều chế hóa học[sửa|sửa mã nguồn]
Khi đang chuẩn bị sẵn sàng một hội nghị kỷ niệm 100 năm thành tựu của Moissan vào năm 1986, Karl O. Christe tìm ra rằng việc điều chế fluor về mặt hóa học là hoàn toàn có thể thực thi được trên cơ sở rằng phản ứng giữa một muối fluoride của sắt kẽm kim loại có trạng thái oxy hóa cao và một chất nhận ion fluoride mạnh làm sinh ra fluoride sắt kẽm kim loại không bền, một chất sau đó bị phân hủy để tạo ra khí fluor. [ 174 ] [ 175 ] Ông trình diễn một giải pháp để thu được fluor với hiệu suất cao và áp suất ở mức khí quyển : [ 176 ]
Christe về sau phản hồi thêm rằng những chất phản ứng ” đã được biết đến trong hơn 100 năm và thậm chí còn cả Moissan hoàn toàn có thể đến được với giải pháp này “. [ 177 ] Ít nhất đến năm 2008, 1 số ít tài liệu vẫn xác nhận rằng fluor có năng lực phản ứng cao đến mức khó hoàn toàn có thể điều chế và phân lập được. [ 178 ]
Ứng dụng trong công nghiệp[sửa|sửa mã nguồn]
Khai thác fluorit, nguồn phân phối fluor hầu hết cho toàn quốc tế, đạt đỉnh vào năm 1989 khi có 5,6 triệu tấn quặng được khai thác. Các lao lý hạn chế sử dụng chlorofluorocarbon được phát hành làm số lượng này giảm xuống còn 3,6 triệu tấn vào năm 1994 ; việc sản xuất về sau tăng trưởng trở lại. Khoảng 4,5 triệu tấn quặng với tổng giá trị 550 triệu USD được tạo ra vào năm 2003 ; những báo cáo giải trình về sau ước tính tổng doanh thu ngành hóa học fluor toàn thế giới năm 2011 đạt 15 tỷ USD và dự báo giá trị sản xuất từ năm năm nay đến 2018 là từ 3,5 đến 5,9 triệu tấn cùng tổng doanh thu tối thiểu 20 tỷ USD. [ 78 ] [ 179 ] [ 180 ] [ 181 ] [ 182 ] Lượng fluorit khai thác được chia thành hai phân khúc chính với tỷ suất bằng nhau : fluorit có độ tinh khiết từ 60 – 85 % ( metspar ) hầu hết được sử dụng trong nấu luyện sắt trong khi loại tinh khiết trên 97 % ( acidspar ) thường được chuyển thành chất trung gian phản ứng hydro fluoride chủ chốt trong công nghiệp. [ 62 ] [ 78 ] [ 183 ] Biểu đồ phân bổ ngành công nghiệp hóa học fluor
Biểu đồ phân bổ ngành công nghiệp hóa học fluor 6 tại một đường ray ở NgaMáy biến áp SFtại một đường ray ở Nga
6 tại một đường ray ở NgaMáy biến áp SFtại một đường ray ở Nga
Ít nhất 17.000 tấn fluor được sản xuất mỗi năm. Nó chỉ có chi phí khoảng từ 5 đến 8 USD mỗi kilôgam dưới dạng urani hoặc lưu huỳnh hexafluoride, nhưng cao hơn nhiều lần dưới dạng nguyên tố do vấn đề về vận chuyển. Đa số quá trình sử dụng lượng lớn fluor tự do áp dụng kỹ thuật tạo ra tại chỗ (in situ) dưới hình thức hội nhập theo chiều dọc.
Ứng dụng lớn nhất của khí fluor, tiêu thụ khoảng chừng 7.000 tấn mỗi năm, là trong quy trình điều chế UF6 cho quy trình nguyên vật liệu hạt nhân. Fluor được sử dụng để fluor hóa urani ( IV ) fluoride, một chất được tự tổng hợp từ urani dioxide và acid hydrofluoric. Fluor là chất đơn đồng vị, nên sự khác nhau về khối lượng giữa những phân tử UF6 là do sự sống sót của 235U hoặc 238U, được cho phép làm giàu urani qua khuếch tán dạng thể khí hoặc máy ly tâm khí. [ 62 ] Khoảng 6.000 tấn fluor hàng năm được đi vào sản xuất SF6 điện môi trơ cho máy biến áp cao thế và cầu dao điện, vô hiệu nhu yếu về chất nguy cơ tiềm ẩn PCB có tương quan với thiết bị sử dụng dầu. Một số hợp chất của fluor được ứng dụng trong điện tử : rheni và wolfram hexafluoride trong và lắng đọng hơi hoá học, tetrafluoromethan trong khắc plasma [ 187 ] [ 188 ] và nitơ trifluoride trong thiết bị tẩy rửa. [ 62 ] Fluor cũng được dùng trong việc tổng hợp fluoride hữu cơ, nhưng năng lực phản ứng của nó yên cầu nó thứ nhất phải được chuyển về ClF3, BrF3 hoặc IF5, những chất đồng thời được cho phép diễn ra quy trình fluor hoá có hiệu chỉnh. Các loại dược phẩm đã fluor hóa sử dụng lưu huỳnh tetrafluoride để thay thế sửa chữa. [ 62 ]
Fluoride vô cơ[sửa|sửa mã nguồn]
 Chiết tách nhôm phụ thuộc vào đặc biệt quan trọng vào cryoliteGiống như những kim loại tổng hợp của sắt khác, khoảng chừng 3 kg metspar được thêm vào mỗi tấn thép ; những ion fluoride làm giảm nhiệt độ nóng chảy và độ nhớt của nó. [ 62 ] [ 189 ] Cùng với vai trò làm chất phụ gia trong 1 số ít nguyên vật liệu như men và lớp phủ đũa hàn, phần nhiều acidspar được cho phản ứng với acid sulfuric để tạo thành acid hydrofluoric, một chất được sử dụng trong tẩy gỉ thép, khắc kính và cracking alkane. [ 62 ] Một phần ba HF được dùng trong tổng hợp cryolite và nhôm fluoride, sau đó cả hai chảy theo dòng trong công nghệ tiên tiến Hall − Héroult để chiết tách nhôm ; việc bổ trợ là thiết yếu do nhiều lúc chúng phản ứng với dụng cụ nấu luyện. Mỗi tấn nhôm cần khoảng chừng 23 kg nhôm fluoride. [ 62 ] [ 190 ] Fluorosilicat tiêu thụ một lượng chiếm tỷ suất nhiều thứ hai, trong đó natri hexafluorosilicat ( IV ) sử dụng trong fluor hóa nước và giải quyết và xử lý nước thải, và được dùng dưới dạng chất trung gian phản ứng để sản xuất cryolite và silic tetrafluoride. Một số fluoride vô cơ quan trọng khác gồm có muối fluoride của cobalt, nickel và amoni. [ 62 ] [ 192 ]
Chiết tách nhôm phụ thuộc vào đặc biệt quan trọng vào cryoliteGiống như những kim loại tổng hợp của sắt khác, khoảng chừng 3 kg metspar được thêm vào mỗi tấn thép ; những ion fluoride làm giảm nhiệt độ nóng chảy và độ nhớt của nó. [ 62 ] [ 189 ] Cùng với vai trò làm chất phụ gia trong 1 số ít nguyên vật liệu như men và lớp phủ đũa hàn, phần nhiều acidspar được cho phản ứng với acid sulfuric để tạo thành acid hydrofluoric, một chất được sử dụng trong tẩy gỉ thép, khắc kính và cracking alkane. [ 62 ] Một phần ba HF được dùng trong tổng hợp cryolite và nhôm fluoride, sau đó cả hai chảy theo dòng trong công nghệ tiên tiến Hall − Héroult để chiết tách nhôm ; việc bổ trợ là thiết yếu do nhiều lúc chúng phản ứng với dụng cụ nấu luyện. Mỗi tấn nhôm cần khoảng chừng 23 kg nhôm fluoride. [ 62 ] [ 190 ] Fluorosilicat tiêu thụ một lượng chiếm tỷ suất nhiều thứ hai, trong đó natri hexafluorosilicat ( IV ) sử dụng trong fluor hóa nước và giải quyết và xử lý nước thải, và được dùng dưới dạng chất trung gian phản ứng để sản xuất cryolite và silic tetrafluoride. Một số fluoride vô cơ quan trọng khác gồm có muối fluoride của cobalt, nickel và amoni. [ 62 ] [ 192 ]
Fluoride hữu cơ[sửa|sửa mã nguồn]
Hợp chất fluoride hữu cơ tiêu thụ khoảng chừng 20 % lượng fluorit khai thác và hơn 40 % lượng acid hydrofluoric, trong đó khí làm lạnh chiếm lợi thế và fluoropolymer đang tăng trưởng về thị trường. [ 62 ] [ 193 ] Chất hoạt động giải trí mặt phẳng là một ứng dụng nhỏ của fluor nhưng đem lại khoảng chừng 1 tỷ USD lệch giá hàng năm. [ 194 ] Do rủi ro tiềm ẩn gây hại từ phản ứng hydrocarbon – fluor trực tiếp ở nhiệt độ trên – 150 °C ( – 240 °F ), việc sản xuất fluorocarbon trong công nghiệp được thực thi gián tiếp, hầu hết qua những phản ứng trao đổi halogen ví dụ điển hình như phản ứng fluor hóa Swarts, trong đó những nguyên tử chlor trong chlorocarbon được sửa chữa thay thế bằng fluor bởi acid hydrofluoric kèm xúc tác. Phản ứng fluor hóa điện hóa đưa hydrocarbon ra điện phân trong hydro fluoride, và quy trình Fowler giải quyết và xử lý chúng bằng những chất chứa fluor dạng rắn như cobalt ( III ) fluoride. [ 91 ] [ 195 ]
Khí làm lạnh[sửa|sửa mã nguồn]
Các chất làm lạnh đã halogen hóa, còn có tên gọi là Freon, [ gc 18 ] được định danh bằng số R chỉ lượng fluor, chlor, carbon và hydro có trong nó. [ 62 ] [ 196 ] Các hợp chất chlorofluorocarbon ( CFC ) như R-11, R-12 và R-114 từng chiếm vai trò chủ yếu trong nhóm hợp chất hữu cơ của fluor, đạt đỉnh về sản xuất trong thập niên 1980. Được sử dụng trong những mạng lưới hệ thống máy điều hòa, chất nổ đẩy và dung môi, sản lượng sản xuất chúng đến đầu thập niên 2000 chỉ còn bằng dưới một phần mười so với mức đỉnh sau khi nhiều vương quốc phát hành lệnh cấm sử dụng. [ 62 ] Hydrochlorofluorocarbon ( HCFC ) và hydrofluorocarbon ( HFC ) được xem là những chất sửa chữa thay thế ; hơn 90 % lượng fluor trong công nghiệp hữu cơ được dùng để tổng hợp chúng. Các chất HCFC quan trọng gồm có R-22, chlorodifluoromethan và R-141b. Loại HFC chính hiện tại là R-134a [ 62 ] cùng với một dạng phân tử mới HFO-1234yf, một hydrofluoroolefin đang dần trở nên điển hình nổi bật do có rủi ro tiềm ẩn gây ấm lên toàn thế giới chỉ bằng dưới 1 % so với HFC-134a. [ 197 ]
Bài chi tiết cụ thể : FluoropolymeCó khoảng chừng 180.000 tấn fluoropolyme được sản xuất vào năm 2006 và 2007, tạo ra lệch giá hơn 3,5 tỷ USD mỗi năm. [ 198 ] Tổng doanh thu thị trường fluoropolyme toàn thế giới được ước tính là gần 6 tỷ USD vào năm 2011 và được dự báo tăng trưởng 6,5 % mỗi năm đến năm năm nay. [ 199 ] Fluoropolyme chỉ hoàn toàn có thể được tạo thành bằng cách polyme hóa những gốc tự do .Polytetrafluoroetylen ( PTFE ), còn được gọi là Teflon theo tên tên thương hiệu của DuPont, [ 200 ] chiếm khoảng chừng 60 – 80 % khối lượng fluoropolyme được sản xuất trên quốc tế. [ 198 ] Ứng dụng lớn nhất của nó là làm chất cách điện vì PTFE là một chất điện môi rất tốt. Nó cũng được sử dụng làm chất chống ăn mòn trong công nghiệp hóa học khi thiết yếu, đặc biệt quan trọng làm lớp tráng đường ống. Một ứng dụng đa phần khác là trong vải sợi thủy tinh bọc bởi PTFE để làm mái che sân vận động. Ứng dụng thương mại lớn nhất của nó là trong dụng cụ căn phòng nhà bếp chống dính. [ 200 ] Phim PTFE bị kéo dãn và giật trở thành PTFE dạng mềm ( ePTFE ), một loại màng tổng hợp có lỗ rỗ nhỏ với tên tên thương hiệu là Gore-Tex, được sử dụng để sản xuất áo mưa, thiết bị bảo lãnh cá thể và màng lọc ; sợi ePTFE hoàn toàn có thể dùng để sản xuất phớt cơ khí và màng lọc bụi. [ 200 ] Một số loại fluoropolyme khác, gồm có etylen propylen fluor hóa, cũng có những đặc thù của PTFE và hoàn toàn có thể dùng thay thế sửa chữa cho nó ; chúng dễ dập khuôn hơn nhưng có ngân sách cao hơn và tính chịu nhiệt kém hơn. Phim nhựa từ hai loại fluoropolyme khác nhau sửa chữa thay thế thủy tinh trong pin Mặt Trời. [ 200 ] [ 201 ]Các chất ionome fluor hóa, những chất bền về mặt hóa học nhưng ngân sách cao, được dùng làm màng bọc pin điện hóa, trong đó chất được kể đến tiên phong và điển hình nổi bật nhất là Nafion. Được tăng trưởng từ những năm 1960, Nafion bắt đầu được sử dụng làm vật tư trong pin nguyên vật liệu của những thiết bị thiên hà và sau đó thay thế sửa chữa pin xút – chlor làm từ thủy ngân. Gần đây, ứng dụng làm pin nguyên vật liệu khởi đầu Open trở lại với những nỗ lực để lắp ráp pin nguyên vật liệu màng trao đổi proton trên xe xe hơi. [ 202 ] [ 203 ] [ 204 ] Các loại fluoroelastome ví dụ điển hình như Viton là hỗn hợp fluoropolyme link ngang được ứng dụng hầu hết để làm vòng chữ O ; [ 200 ] perfluorobutan ( C4F10 ) được dùng làm chất dập tắt đám cháy .
Chất hoạt động giải trí mặt phẳng[sửa|sửa mã nguồn]
 Vải bọc lớp phủ chống thấm nước thường có tính kỵ nướcChất hoạt động giải trí mặt phẳng fluor hóa là những phân tử nhỏ hữu cơ chứa fluor được sử dụng để chống thấm nước và vết bẩn. Mặc dù có giá đắt đỏ ( so sánh được với dược phẩm ở khoảng chừng 200 đến 2 nghìn USD một kilôgam ), chúng tạo ra lệch giá hàng năm hơn 1 tỷ USD đến năm 2006 ; riêng doanh thu của Scotchgard là hơn 300 triệu USD vào năm 2000. [ 194 ] [ 206 ] [ 207 ] Chất hoạt động giải trí mặt phẳng fluor hóa chỉ chiếm tỷ trọng nhỏ trong thị trường chất hoạt động giải trí mặt phẳng, trong đó những sản phẩm giá rẻ làm từ hydrocarbon chiếm phần nhiều thị trường. Ứng dụng trong sơn vẫn còn hạn chế do ngân sách trộn lẫn và tổng hợp, với tổng sản lượng chỉ khoảng chừng 100 triệu USD vào năm 2006. [ 194 ]
Vải bọc lớp phủ chống thấm nước thường có tính kỵ nướcChất hoạt động giải trí mặt phẳng fluor hóa là những phân tử nhỏ hữu cơ chứa fluor được sử dụng để chống thấm nước và vết bẩn. Mặc dù có giá đắt đỏ ( so sánh được với dược phẩm ở khoảng chừng 200 đến 2 nghìn USD một kilôgam ), chúng tạo ra lệch giá hàng năm hơn 1 tỷ USD đến năm 2006 ; riêng doanh thu của Scotchgard là hơn 300 triệu USD vào năm 2000. [ 194 ] [ 206 ] [ 207 ] Chất hoạt động giải trí mặt phẳng fluor hóa chỉ chiếm tỷ trọng nhỏ trong thị trường chất hoạt động giải trí mặt phẳng, trong đó những sản phẩm giá rẻ làm từ hydrocarbon chiếm phần nhiều thị trường. Ứng dụng trong sơn vẫn còn hạn chế do ngân sách trộn lẫn và tổng hợp, với tổng sản lượng chỉ khoảng chừng 100 triệu USD vào năm 2006. [ 194 ]
Sản phẩm nông hóa học[sửa|sửa mã nguồn]
Khoảng 30 % loại sản phẩm nông hóa học có chứa fluor, [ 208 ] phần nhiều trong đó là thuốc diệt cỏ và thuốc diệt nấm cùng một vài chất kích thích hoặc ức chế cây xanh. Phản ứng thế bởi fluor, thường là của một nguyên tử hoặc nhiều nhất là một nhóm trifluorometyl, làm biến hóa mạnh những đặc thù tương tự như như dược phẩm fluor hóa. [ 209 ] Trifluralin là một ví dụ điển hình nổi bật, được sử dụng phổ cập làm chất diệt cỏ dại, [ 209 ] [ 210 ] nhưng được cho là một chất gây ung thư và đã bị cấm sử dụng tại nhiều vương quốc châu Âu. [ 211 ] Natri fluoroacetat ( 1080 ) là một chất độc với động vật hoang dã có vú, trong đó hai nguyên tử hydro trong acid acetic được thế bằng fluor và natri ; nó làm phá vỡ trao đổi chất trong tế bào bằng cách thay thế sửa chữa acetat trong quy trình Krebs. Được tổng hợp lần đầu vào thế kỷ 19, nó được xếp loại là thuốc trừ sâu vào đầu thế kỷ 20 và sau này được sản xuất và sử dụng đại trà phổ thông như thời nay. New Zealand, vương quốc tiêu thụ 1080 nhiều nhất, sử dụng nó để bảo vệ chim kiwi khỏi sự xâm lấn từ cáo túi đuôi chổi nước Australia. [ 212 ] Châu Âu và Hoa Kỳ đã cấm hoặc hạn chế sử dụng 1080. [ 214 ] [ gc 19 ]
Ứng dụng trong y tế[sửa|sửa mã nguồn]
Chăm sóc răng miệng[sửa|sửa mã nguồn]
 Điều trị tại chỗ bằng fluoride ở PanamaCác nghiên cứu và điều tra từ giữa thế kỷ 20 cho thấy điều trị tại chỗ bằng fluoride làm giảm sâu răng. Điều này bắt đầu được lý giải là do hydroxyapatite trong men răng được chuyển thành fluorapatite bền hơn, nhưng những điều tra và nghiên cứu trên răng chưa fluor hóa đã bác bỏ giả thuyết này, và thời nay hiện tượng kỳ lạ này được lý giải là do fluoride giúp phục sinh men răng tại những lỗ sâu nhỏ. [ 215 ] Sau những nghiên cứu và điều tra trong trẻ nhỏ tại những khu vực mà fluor có trong nước uống một cách tự nhiên, công cuộc fluor hóa nguồn nước hoạt động và sinh hoạt để chống sâu răng [ 216 ] khởi đầu vào thập niên 1940 và đến nay đã được vận dụng với nguồn nước phân phối cho 6 % dân số quốc tế, gồm có hai phần ba người dân Hoa Kỳ. [ 217 ] [ 218 ] Các bài bình duyệt học thuật vào năm 2000 và 2007 cho thấy có mối liên hệ giữa fluor hóa nước và sự suy giảm mạnh triệu chứng sâu răng ở trẻ nhỏ. [ 219 ] Mặc dù nhận được sự ủng hộ như vậy, cũng như có dẫn chứng cho thấy không có tính năng bất lợi ngoài triệu chứng răng nhiễm độc fluor ở mức nhẹ ở đa phần trường hợp, [ 220 ] tuy nhiên những tranh cãi về mặt đạo đức và bảo đảm an toàn vẫn còn tiếp nối. [ 218 ] [ 221 ] Lợi ích từ việc fluor hóa này đã và đang giảm xuống hoàn toàn có thể do sự Open của những nguồn fluoride thay thế sửa chữa, nhưng vẫn đong đếm được ở nhóm thu nhập thấp. [ 222 ] Natri monofluorophosphat cùng với natri hoặc thiếc ( II ) fluoride thường được tìm thấy trong những loại kem đánh răng fluoride, một loại sản phẩm lần tiên phong được ra mắt tại Hoa Kỳ vào năm 1955 và hiện rất phổ cập ở những vương quốc tăng trưởng, cùng với nước súc miệng, gel, bọt và vecni fluor hóa. [ 222 ] [ 223 ]
Điều trị tại chỗ bằng fluoride ở PanamaCác nghiên cứu và điều tra từ giữa thế kỷ 20 cho thấy điều trị tại chỗ bằng fluoride làm giảm sâu răng. Điều này bắt đầu được lý giải là do hydroxyapatite trong men răng được chuyển thành fluorapatite bền hơn, nhưng những điều tra và nghiên cứu trên răng chưa fluor hóa đã bác bỏ giả thuyết này, và thời nay hiện tượng kỳ lạ này được lý giải là do fluoride giúp phục sinh men răng tại những lỗ sâu nhỏ. [ 215 ] Sau những nghiên cứu và điều tra trong trẻ nhỏ tại những khu vực mà fluor có trong nước uống một cách tự nhiên, công cuộc fluor hóa nguồn nước hoạt động và sinh hoạt để chống sâu răng [ 216 ] khởi đầu vào thập niên 1940 và đến nay đã được vận dụng với nguồn nước phân phối cho 6 % dân số quốc tế, gồm có hai phần ba người dân Hoa Kỳ. [ 217 ] [ 218 ] Các bài bình duyệt học thuật vào năm 2000 và 2007 cho thấy có mối liên hệ giữa fluor hóa nước và sự suy giảm mạnh triệu chứng sâu răng ở trẻ nhỏ. [ 219 ] Mặc dù nhận được sự ủng hộ như vậy, cũng như có dẫn chứng cho thấy không có tính năng bất lợi ngoài triệu chứng răng nhiễm độc fluor ở mức nhẹ ở đa phần trường hợp, [ 220 ] tuy nhiên những tranh cãi về mặt đạo đức và bảo đảm an toàn vẫn còn tiếp nối. [ 218 ] [ 221 ] Lợi ích từ việc fluor hóa này đã và đang giảm xuống hoàn toàn có thể do sự Open của những nguồn fluoride thay thế sửa chữa, nhưng vẫn đong đếm được ở nhóm thu nhập thấp. [ 222 ] Natri monofluorophosphat cùng với natri hoặc thiếc ( II ) fluoride thường được tìm thấy trong những loại kem đánh răng fluoride, một loại sản phẩm lần tiên phong được ra mắt tại Hoa Kỳ vào năm 1955 và hiện rất phổ cập ở những vương quốc tăng trưởng, cùng với nước súc miệng, gel, bọt và vecni fluor hóa. [ 222 ] [ 223 ]
 Thuốc fluoxetineKhoảng 20 % dược phẩm văn minh có chứa fluor. [ 224 ] Một trong số đó, thuốc làm giảm cholesterol atorvastatin ( Lipitor ), có lệch giá nhiều hơn bất kể loại thuốc nào khác đến khi nó trở thành thuốc gốc vào năm 2011. [ 225 ] Thuốc kê toa chữa hen phế quản Seretide với doanh thu đứng trong top 10 vào giữa thập niên 2000 chứa hai thành phần công hiệu, trong đó fluticasone là chất đã fluor hóa. [ 226 ] Nhiều loại dược phẩm được fluor hóa để làm chậm lại thời gian bất hoạt do link carbon – fluor rất bền. [ 227 ] Fluor hóa cũng làm tăng tính tan trong chất mỡ do link này có tính kỵ nước cao hơn link carbon – hydro, và đặc thù này tác động ảnh hưởng đến sự xâm nhập của thuốc lên màng tế bào, kéo theo sinh khả dụng tăng lên. [ 226 ]Thuốc chống trầm cảm ba vòng cùng 1 số ít loại thuốc chống trầm cảm khác trước những năm 1980 có 1 số ít công dụng phụ do sự can thiệp không tinh lọc của chúng với chất dẫn truyền thần kinh thay vì tác nhân chính serotonin ; fluoxetine đã fluor hóa trở thành một trong những loại thuốc tiên phong tránh được yếu tố này. Nhiều loại thuốc chống trầm cảm ngày này cũng có công dụng tựa như, gồm có thuốc ức chế tái hấp thu serotonin có tinh lọc : citalopram cùng đồng phân escitalopram, fluvoxamine và paroxetine. [ 228 ] [ 229 ] Quinolone là kháng sinh phổ rộng tự tạo thường được fluor hóa để làm tăng phổ tắc dụng. Chúng gồm có ciprofloxacin và levofloxacin. [ 230 ] [ 231 ] [ 232 ] [ 233 ] Fluor cũng có trong một số ít loại steroid : [ 234 ] fludrocortisone là một loại mineralocorticoid làm tăng huyết áp, còn triamcinolone và dexamethasone là những glucocorticoid mạnh. [ 235 ] Đa số thuốc gây mê hít vào được fluor hóa mạnh ; thuốc tiên phong như vậy, halothane, có tính trơ và hiệu nghiệm lớn hơn nhiều so với những loại khác cùng thời. Các hợp chất về sau ví dụ điển hình như ether đã fluor hóa, trong đó gồm sevoflurane và desflurane, được xem là tốt hơn halothane và gần như không tan trong máu, được cho phép thời hạn tỉnh lại nhanh hơn. [ 236 ] [ 237 ]
Thuốc fluoxetineKhoảng 20 % dược phẩm văn minh có chứa fluor. [ 224 ] Một trong số đó, thuốc làm giảm cholesterol atorvastatin ( Lipitor ), có lệch giá nhiều hơn bất kể loại thuốc nào khác đến khi nó trở thành thuốc gốc vào năm 2011. [ 225 ] Thuốc kê toa chữa hen phế quản Seretide với doanh thu đứng trong top 10 vào giữa thập niên 2000 chứa hai thành phần công hiệu, trong đó fluticasone là chất đã fluor hóa. [ 226 ] Nhiều loại dược phẩm được fluor hóa để làm chậm lại thời gian bất hoạt do link carbon – fluor rất bền. [ 227 ] Fluor hóa cũng làm tăng tính tan trong chất mỡ do link này có tính kỵ nước cao hơn link carbon – hydro, và đặc thù này tác động ảnh hưởng đến sự xâm nhập của thuốc lên màng tế bào, kéo theo sinh khả dụng tăng lên. [ 226 ]Thuốc chống trầm cảm ba vòng cùng 1 số ít loại thuốc chống trầm cảm khác trước những năm 1980 có 1 số ít công dụng phụ do sự can thiệp không tinh lọc của chúng với chất dẫn truyền thần kinh thay vì tác nhân chính serotonin ; fluoxetine đã fluor hóa trở thành một trong những loại thuốc tiên phong tránh được yếu tố này. Nhiều loại thuốc chống trầm cảm ngày này cũng có công dụng tựa như, gồm có thuốc ức chế tái hấp thu serotonin có tinh lọc : citalopram cùng đồng phân escitalopram, fluvoxamine và paroxetine. [ 228 ] [ 229 ] Quinolone là kháng sinh phổ rộng tự tạo thường được fluor hóa để làm tăng phổ tắc dụng. Chúng gồm có ciprofloxacin và levofloxacin. [ 230 ] [ 231 ] [ 232 ] [ 233 ] Fluor cũng có trong một số ít loại steroid : [ 234 ] fludrocortisone là một loại mineralocorticoid làm tăng huyết áp, còn triamcinolone và dexamethasone là những glucocorticoid mạnh. [ 235 ] Đa số thuốc gây mê hít vào được fluor hóa mạnh ; thuốc tiên phong như vậy, halothane, có tính trơ và hiệu nghiệm lớn hơn nhiều so với những loại khác cùng thời. Các hợp chất về sau ví dụ điển hình như ether đã fluor hóa, trong đó gồm sevoflurane và desflurane, được xem là tốt hơn halothane và gần như không tan trong máu, được cho phép thời hạn tỉnh lại nhanh hơn. [ 236 ] [ 237 ]
 18F PET toàn thânẢnh chụpF PET body toàn thânFluor-18 thường được tìm thấy trong chất lưu lại phóng xạ cho việc chụp cắt lớp phát xạ positron, vì chu kỳ luân hồi bán rã gần 2 giờ của nó là đủ dài để luân chuyển từ cơ sở sản xuất đến TT tổng hợp ảnh y khoa. [ 238 ] Chất ghi lại thông dụng nhất là fludeoxyglucose, [ 238 ] một chất mà sau khi được tiêm vào tĩnh mạch thì được đưa lên bởi những mô đang cần glucose như não và hầu hết khối u ác tính ; [ 239 ] sau đó, hoàn toàn có thể sử dụng công nghệ tiên tiến chụp cắt lớp vi tính để phân phối hình ảnh cụ thể. [ 240 ]
18F PET toàn thânẢnh chụpF PET body toàn thânFluor-18 thường được tìm thấy trong chất lưu lại phóng xạ cho việc chụp cắt lớp phát xạ positron, vì chu kỳ luân hồi bán rã gần 2 giờ của nó là đủ dài để luân chuyển từ cơ sở sản xuất đến TT tổng hợp ảnh y khoa. [ 238 ] Chất ghi lại thông dụng nhất là fludeoxyglucose, [ 238 ] một chất mà sau khi được tiêm vào tĩnh mạch thì được đưa lên bởi những mô đang cần glucose như não và hầu hết khối u ác tính ; [ 239 ] sau đó, hoàn toàn có thể sử dụng công nghệ tiên tiến chụp cắt lớp vi tính để phân phối hình ảnh cụ thể. [ 240 ]
Chất luân chuyển oxy[sửa|sửa mã nguồn]
Fluorocarbon lỏng hoàn toàn có thể tải và luân chuyển lượng lớn thể tích oxy hoặc carbon dioxide, lớn hơn nhiều so với máu, và đã lôi cuốn sự chăm sóc với năng lực được ứng dụng trong máu tự tạo và thở chất lỏng. [ 241 ] Do fluorocarbon không hề tạo thành hỗn hợp với nước theo cách thường thì, chúng phải được trộn với nhũ tương ( những giọt bắn perfluorocarbon nhỏ lơ lửng trong nước ) để sửa chữa thay thế cho máu. [ 242 ] [ 243 ] Oxycyte, một loại mẫu sản phẩm như vậy, đã trải qua những tiến trình thử nghiệm lâm sàng bắt đầu. [ 244 ] Các chất này hoàn toàn có thể làm tăng sức bền của vận động viên và đã bị cấm trong thể thao ; một trường hợp tay lái xe đạp điện suýt tử trận vào năm 1998 đã dẫn đến một cuộc tìm hiểu tương quan đến chúng. [ 245 ] [ 246 ] Một số ứng dụng của thở chất lỏng perfluorocarbon tinh khiết ( sử dụng chất lỏng perfluorocarbon tinh khiết thay vì nhũ tương nước ) gồm có tương hỗ người bị bỏng và trẻ sinh non bằng phổi thiếu khuyết. Các quy trình ghép phổi một phần và vừa đủ đều đã được điều tra và nghiên cứu và xem xét, dù chỉ có ghép phổi một phần là được thử nghiệm thoáng rộng trên người. [ 247 ] Phương pháp ghép một phần của Alliance Pharmaceuticals từng được thử nghiệm lâm sàng nhưng đã bị chấm hết vì hiệu suất cao không tốt hơn so với những liệu pháp thường thì. [ 248 ]
Vai trò sinh học[sửa|sửa mã nguồn]
 Dichapetalum cymosum là một trong số ít sinh vật tổng hợp được hợp chất hữu cơ của fluorlà một trong số ít sinh vật tổng hợp được hợp chất hữu cơ của fluorFluor là nguyên tố không thiết yếu so với người hoặc động vật hoang dã có vú ; một lượng nhỏ fluor hoàn toàn có thể làm tăng độ bền chắc của xương, nhưng hiệu suất cao này vẫn chưa được xác định một cách rõ ràng. Do có nhiều nguồn chứa fluor lượng nhỏ trong thiên nhiên và môi trường, năng lực thiếu fluor chỉ hoàn toàn có thể xảy ra do chính sách ăn của người ; [ 249 ] lượng fluor thiết yếu và tương thích trong khẩu phần ăn hàng ngày được khuyến nghị dựa trên nhu yếu dinh dưỡng khuyến nghị do Tổ chức Y tế Thế giới [ 250 ] và Viện Y học, Viện Hàn lâm Khoa học Quốc gia Hoa Kỳ [ 251 ] phát hành, khác nhau tùy theo độ tuổi và giới tính .Hợp chất cơ fluor tự nhiên đã được tìm thấy trong vi sinh vật và thực vật nhưng không có ở động vật hoang dã. [ 252 ] Loại phổ cập nhất là fluoroacetat, được sử dụng làm chất chống lại động vật hoang dã ăn thực vật có trong tối thiểu 40 loại thực vật ở châu Phi, nước Australia và Brasil. Một số ví dụ khác gồm có acid béo fluor hóa, fluoroacetone và 2 – fluorocitrat. [ 252 ] Fluorinase, một enzyme link fluor với carbon, được phát hiện trong vi trùng vào năm 2002. [ 253 ]
Dichapetalum cymosum là một trong số ít sinh vật tổng hợp được hợp chất hữu cơ của fluorlà một trong số ít sinh vật tổng hợp được hợp chất hữu cơ của fluorFluor là nguyên tố không thiết yếu so với người hoặc động vật hoang dã có vú ; một lượng nhỏ fluor hoàn toàn có thể làm tăng độ bền chắc của xương, nhưng hiệu suất cao này vẫn chưa được xác định một cách rõ ràng. Do có nhiều nguồn chứa fluor lượng nhỏ trong thiên nhiên và môi trường, năng lực thiếu fluor chỉ hoàn toàn có thể xảy ra do chính sách ăn của người ; [ 249 ] lượng fluor thiết yếu và tương thích trong khẩu phần ăn hàng ngày được khuyến nghị dựa trên nhu yếu dinh dưỡng khuyến nghị do Tổ chức Y tế Thế giới [ 250 ] và Viện Y học, Viện Hàn lâm Khoa học Quốc gia Hoa Kỳ [ 251 ] phát hành, khác nhau tùy theo độ tuổi và giới tính .Hợp chất cơ fluor tự nhiên đã được tìm thấy trong vi sinh vật và thực vật nhưng không có ở động vật hoang dã. [ 252 ] Loại phổ cập nhất là fluoroacetat, được sử dụng làm chất chống lại động vật hoang dã ăn thực vật có trong tối thiểu 40 loại thực vật ở châu Phi, nước Australia và Brasil. Một số ví dụ khác gồm có acid béo fluor hóa, fluoroacetone và 2 – fluorocitrat. [ 252 ] Fluorinase, một enzyme link fluor với carbon, được phát hiện trong vi trùng vào năm 2002. [ 253 ]



 [254]Nhãn cảnh báo nhắc nhở của Hoa Kỳ so với fluor được luân chuyển thương mạiNguyên tố fluor cực độc so với sinh vật sống. Ảnh hưởng đến con người mở màn tại nồng độ nhỏ hơn so với mức 50 ppm của hydro cyanide [ 255 ] và tương tự với mức của chlor : [ 256 ] hiện tượng kỳ lạ mắt và hệ hô hấp bị tấy lên nặng cùng với tổn thương gan và thận xảy ra ở mức trên 25 ppm, mức độ nguy hại tức thời so với fluor. [ 257 ] Mắt và mũi bị tổn thương nghiêm trọng tại 100 ppm, [ 257 ] và hít phải 1.000 ppm fluor sẽ gây tử trận trong vài phút, [ 258 ] so với mức 270 ppm của hydro cyanide. [ 259 ]
[254]Nhãn cảnh báo nhắc nhở của Hoa Kỳ so với fluor được luân chuyển thương mạiNguyên tố fluor cực độc so với sinh vật sống. Ảnh hưởng đến con người mở màn tại nồng độ nhỏ hơn so với mức 50 ppm của hydro cyanide [ 255 ] và tương tự với mức của chlor : [ 256 ] hiện tượng kỳ lạ mắt và hệ hô hấp bị tấy lên nặng cùng với tổn thương gan và thận xảy ra ở mức trên 25 ppm, mức độ nguy hại tức thời so với fluor. [ 257 ] Mắt và mũi bị tổn thương nghiêm trọng tại 100 ppm, [ 257 ] và hít phải 1.000 ppm fluor sẽ gây tử trận trong vài phút, [ 258 ] so với mức 270 ppm của hydro cyanide. [ 259 ]
 [260]Vết bỏng acid hydrofluoric hoàn toàn có thể không thấy rõ trong 24 giờ, sau thời hạn đó việc cứu chữa bằng calci trở nên kém hiệu suất cao .Acid hydrofluoric là một chất độc tiếp xúc với độc tính cao hơn so với nhiều acid mạnh như acid sulfuric dù đó là acid yếu : nó vẫn trung tính trong dung dịch nước và do đó thấm qua mô nhanh hơn, kể cả khi hít, nuốt phải hoặc tiếp xúc qua da, và tối thiểu 9 công nhân Hoa Kỳ tử trận trong những vụ tai nạn thương tâm như vậy từ năm 1984 đến năm 1994. Nó phản ứng với calci và magnesi trong máu dẫn đến hạ calci máu và tử trận qua rối loạn nhịp tim. [ 261 ] Sự hình thành calci fluoride không tan gây cảm xúc đau mạnh, [ 262 ] và vết bỏng lớn hơn 160 cm² ( 25 in2 ) hoàn toàn có thể gây ngộ độc body toàn thân trầm trọng. [ 263 ]Vết bỏng acid hoàn toàn có thể không thấy được rõ ràng trong 8 giờ so với HF nồng độ 50 % và tối đa 24 giờ ở nồng độ thấp hơn, và bắt đầu hoàn toàn có thể không thấy đau do hydro fluoride ảnh hưởng tác động đến hoạt động giải trí của những dây thần kinh. Nếu da đã bị tiếp xúc với HF, hoàn toàn có thể làm giảm tổn thương bằng cách rửa dưới vòi nước trong 10 – 15 phút và vô hiệu quần áo dính acid. [ 264 ] Bước tiếp theo thường là dùng calci gluconat có chứa ion calci để chúng link với fluor ; vết bỏng trên da hoàn toàn có thể được chữa bằng gel calci gluconat 2,5 % hoặc dung dịch rửa chuyên được dùng. [ 265 ] [ 266 ] [ 267 ] Trường hợp acid hydrofluoric đã hấp thụ vào khung hình cần liên tục được chăm nom y tế ; calci gluconat hoàn toàn có thể được tiêm hoặc truyền trong tĩnh mạch. Sử dụng calci chloride – một thuốc thử thông dụng trong phòng thí nghiệm – thay cho calci gluconat là bị cấm và hoàn toàn có thể gây biến chứng nghiêm trọng. Một số trường hợp nặng hoàn toàn có thể phải cắt bỏ hoặc cắt cụt những phần bị tổn thương. [ 263 ] [ 268 ]
[260]Vết bỏng acid hydrofluoric hoàn toàn có thể không thấy rõ trong 24 giờ, sau thời hạn đó việc cứu chữa bằng calci trở nên kém hiệu suất cao .Acid hydrofluoric là một chất độc tiếp xúc với độc tính cao hơn so với nhiều acid mạnh như acid sulfuric dù đó là acid yếu : nó vẫn trung tính trong dung dịch nước và do đó thấm qua mô nhanh hơn, kể cả khi hít, nuốt phải hoặc tiếp xúc qua da, và tối thiểu 9 công nhân Hoa Kỳ tử trận trong những vụ tai nạn thương tâm như vậy từ năm 1984 đến năm 1994. Nó phản ứng với calci và magnesi trong máu dẫn đến hạ calci máu và tử trận qua rối loạn nhịp tim. [ 261 ] Sự hình thành calci fluoride không tan gây cảm xúc đau mạnh, [ 262 ] và vết bỏng lớn hơn 160 cm² ( 25 in2 ) hoàn toàn có thể gây ngộ độc body toàn thân trầm trọng. [ 263 ]Vết bỏng acid hoàn toàn có thể không thấy được rõ ràng trong 8 giờ so với HF nồng độ 50 % và tối đa 24 giờ ở nồng độ thấp hơn, và bắt đầu hoàn toàn có thể không thấy đau do hydro fluoride ảnh hưởng tác động đến hoạt động giải trí của những dây thần kinh. Nếu da đã bị tiếp xúc với HF, hoàn toàn có thể làm giảm tổn thương bằng cách rửa dưới vòi nước trong 10 – 15 phút và vô hiệu quần áo dính acid. [ 264 ] Bước tiếp theo thường là dùng calci gluconat có chứa ion calci để chúng link với fluor ; vết bỏng trên da hoàn toàn có thể được chữa bằng gel calci gluconat 2,5 % hoặc dung dịch rửa chuyên được dùng. [ 265 ] [ 266 ] [ 267 ] Trường hợp acid hydrofluoric đã hấp thụ vào khung hình cần liên tục được chăm nom y tế ; calci gluconat hoàn toàn có thể được tiêm hoặc truyền trong tĩnh mạch. Sử dụng calci chloride – một thuốc thử thông dụng trong phòng thí nghiệm – thay cho calci gluconat là bị cấm và hoàn toàn có thể gây biến chứng nghiêm trọng. Một số trường hợp nặng hoàn toàn có thể phải cắt bỏ hoặc cắt cụt những phần bị tổn thương. [ 263 ] [ 268 ]
Fluoride không tan là chất độc ở mức trung bình : 5 – 10 g natri fluoride, hoặc 32 – 64 mg ion fluoride trên mỗi kilôgam khối lượng khung hình là liều lượng gây chết người so với người trưởng thành. [ 269 ] Liều lượng ở mức một phần năm so với liều gây chết hoàn toàn có thể dẫn đến tai hại so với sức khỏe thể chất, [ 270 ] và sử dụng quá liều về vĩnh viễn hoàn toàn có thể gây nhiễm độc fluor ở xương, căn bệnh tác động ảnh hưởng đến hàng triệu người ở châu Phi và châu Á. [ 270 ] [ 271 ] Fluoride được tiêm vào sẽ tạo thành acid hydrofluoric trong dạ dày, sau đó acid này được hấp thụ thuận tiện bởi ruột, tại đó nó xuyên qua màng tế bào, link với calci và tác động ảnh hưởng đến những enzyme khác nhau trước khi được thải ra ngoài qua bài tiết nước tiểu. Giới hạn nhiễm độc được xác lập bằng cách xét nghiệm nước tiểu về năng lực đào thải ion fluoride của khung hình. [ 270 ] [ 272 ]Từ trước đến nay, đa phần ca nhiễm độc fluoride là do vô tình uống phải thuốc trừ sâu chứa fluoride vô cơ. [ 273 ] Đa số cuộc gọi đến những TT chống độc để phản ánh trường hợp ngộ độc fluoride lúc bấy giờ đến từ việc nuốt phải kem đánh răng chứa fluoride. [ 270 ] Sự cố xảy ra trong thiết bị fluor hóa nước là một nguyên do khác : một vụ ngộ độc xảy ra ở bang Alaska, Hoa Kỳ vào tháng 5 năm 1992 làm 300 người bị ảnh hưởng tác động, trong đó có một ca tử trận. [ 274 ] Mối nguy cơ tiềm ẩn từ kem đánh răng càng lớn so với trẻ nhỏ, và Trung tâm trấn áp và phòng ngừa dịch bệnh Hoa Kỳ khuyến nghị nên giám sát trẻ dưới 6 tuổi đánh răng để chúng không nuốt phải kem đánh răng. [ 275 ] Một nghiên cứu cấp khu vực năm 1991 về ngộ độc fluor ở trẻ vị thành niên báo cáo giải trình tổng số 87 ca ngộ độc trong năm 1986, trong đó có một ca tử trận do uống phải thuốc trừ sâu. Đa số ca ngộ độc không có triệu chứng, nhưng khoảng chừng 30 % có triệu chứng đau dạ dày. [ 273 ] Một điều tra và nghiên cứu trên toàn chủ quyền lãnh thổ Hoa Kỳ năm 1997 cũng có phát hiện tựa như : 80 % số ca ngộ độc có tương quan đến trẻ nhỏ dưới 6 tuổi, và có 1 số ít ít ca chuyển nặng. [ 276 ]
Vấn đề môi trường tự nhiên[sửa|sửa mã nguồn]
Nghị định thư Montreal ký vào năm 1987 đặt ra những lao lý khắt khe về chlorofluorocarbon ( CFC ) và bromofluorocarbon dựa trên mức độ rủi ro tiềm ẩn gây suy giảm tầng ozone ( đo bằng chỉ số ODP ). Tính trơ mạnh về mặt hóa học vốn đã giúp chúng từng được sử dụng thoáng rộng cũng đồng nghĩa tương quan với việc chúng không hề bị phân hủy đến khi đi đến độ cao cao hơn, tại đó những nguyên tử chlor và brom tự do phản ứng với những phân tử ozone làm hủy hoại tầng ozone theo chính sách gốc. [ 278 ] Kể cả sau lệnh cấm và những tín hiệu bắt đầu cho thấy tính hiệu suất cao của nó, những nhà khoa học cảnh báo nhắc nhở hoàn toàn có thể sẽ phải mất nhiều thế hệ trước khi tầng ozone được hồi sinh trọn vẹn. [ 279 ] [ 280 ] Với ODP bằng một phần mười so với CFC, hydrochlorofluorocarbon ( HCFC ) là những chất thay thế sửa chữa ở thời gian hiện tại, [ 281 ] và theo dự kiến đến năm 2030 – 2040 sẽ được thay bằng hydrofluorocarbon ( HFC ) không chứa chlor và có ODP bằng 0. [ 282 ] Năm 2007, thời hạn này được lùi lại sớm hơn sang năm 2020 tại những vương quốc tăng trưởng ; [ 283 ] Cơ quan Bảo vệ Môi trường Hoa Kỳ đã cấm sản xuất một loại HCFC và hạn chế sản xuất hai loại khác vào năm 2003. [ 282 ] Khí fluorocarbon thường là loại khí nhà kính với mức độ rủi ro tiềm ẩn gây ấm lên toàn thế giới ( đo bằng chỉ số GWP ) khoảng chừng từ 100 đến 10.000 ; riêng lưu huỳnh hexafluoride là khoảng chừng 20.000. Một ngoại lệ là HFO-1234yf, thuộc một dạng chất làm lạnh mới có tên là hydrofluoroolefin ( HFO ) và đã lôi cuốn sự chăm sóc trên toàn thế giới do có GWP chỉ bằng 4 so với số lượng 1.430 của chất làm lạnh thông dụng lúc bấy giờ HFC-134a. [ 197 ]
Tồn tại sinh học[sửa|sửa mã nguồn]
 Acid perfluorooctansulfonic, một thành phần chính trong Scotchgard của 3M đến năm 2000
Acid perfluorooctansulfonic, một thành phần chính trong Scotchgard của 3M đến năm 2000
Các hợp chất hữu cơ của fluor thể hiện sự tồn tại lâu dài trong môi trường do độ bền của liên kết carbon–fluor. Acid perfluoroalkine (PFAA), những chất ít tan trong nước do các nhóm chức acid của chúng, được cho là chất ô nhiễm hữu cơ khó phân hủy;[286] acid perfluorooctansulfonic (PFOS) và acid perfluorooctanoic (PFOA) là những chất được nghiên cứu thường xuyên nhất.[287][288][289] PFAA đã được tìm thấy ở lượng nhỏ trên thế giới từ gấu Bắc Cực cho đến con người, còn PFOS và PFOA được cho là có trong sữa mẹ và máu của trẻ sơ sinh. Một bài báo năm 2013 cho thấy sự tương quan nhẹ giữa nồng độ PFAA trong nước ngầm và đất với hoạt động của con người; không có dấu hiệu rõ ràng cho thấy một chất hóa học chiếm ưu thế, và lượng PFOS lớn hơn có tương quan với lượng PFOA lớn hơn.[287][288][290] Trong cơ thể, PFAA liên kết với các protein như serum albumin; chúng thường tập trung trong gan và máu của người trước khi được thải ra ngoài qua thận. Thời gian ở lại trong cơ thể khác nhau rất nhiều ở các loài vật khác nhau, với chu kỳ bán rã là vài ngày ở động vật gặm nhấm và vài năm ở người.[287][288][291] Hiện tượng quá liều PFOS và PFOA gây ung thư và tử vong ở động vật gặm nhấm sơ sinh nhưng các nghiên cứu trên người vẫn chưa xác định được ảnh hưởng cụ thể tại mức độ nhiễm độc như hiện tại.[287][288][291]
Liên kết ngoài[sửa|sửa mã nguồn]
Source: https://suachuatulanh.edu.vn
Category : Nạp Gas Tủ Lạnh













































































