Hoá học 10 Bài 22: Clo
1. Tóm tắt kim chỉ nan
1.1. Sơ lược nguyên tố Clo
Kí hiệu hóa học: Cl
Bạn đang đọc: Hoá học 10 Bài 22: Clo
Số ô nguyên tố : 17Cấu hình e : 1 s22s22p63s23p5Khối lượng nguyên tử : 35,5Công thức phân tử : Cl2Khối lượng phân tử : 71
1.2. Tính chất vật lí

Hình 1 : Bình khí CloỞ điều kiện kèm theo thường, Clo là chất khí màu vàng lục, mùi xốc, rất độc .Khí Clo nặng gấp 2,5 lần không khí và tan ít trong nước tạo thành dung dịch nước Clo có màu vàng nhạt, Clo tan nhiều trong những dung môi hữu cơ : Benzen, …
1.3. Tính chất hóa học
Clo biểu lộ tính oxi hóa mạnh chỉ kém hơn Flo và Oxi .Cl + 1 e → Cl -Hay : Cl2 + 2.1 e → 2 Cl -a. Phản ứng với sắt kẽm kim loạiClo tính năng với sắt kẽm kim loại tạo muối Clorua2M + nCl2 → 2MC lnNatri nóng chảy trong khí Clo nóng chảy trong khí clo với ngọn lửa sáng chói, tạo natri clorua :2N a + Cl2 → 2N aClVideo 1 : Natri cháy sáng trong khí cloDây đồng nung nóng đỏ cháy trong không khí clo tạo thành Đồng ( II ) cloruaCu ( đỏ ) + Cl2 ( vàng lục ) → CuCl2 ( trắng )Video 2 : Đồng tính năng với khí CloDây sắt nung nóng đỏ cháy trong khí clo tạo thành khói màu nâu là những hạt sắt ( III ) clorua2F e + 3C l2 → 2F eCl3Video 3 : Sắt công dụng với khí clob. Tác dụng với khí HidroClo tính năng với khí hidro tạo Khí Hiđro Clorua không màu dễ tan trong nước .
H2 + Cl2 → 2HCl
Kết luận : Trong phản ứng với sắt kẽm kim loại và với hiđro thì Clo biểu lộ tính oxi hóa mạnh .c. Tác dụng với nướcKhi tan trong nước một phần Clo phản ứng với nước tạo hỗn hợp hai axit Clohiđric và axit Hypoclorơ .Video 4 : Clo tính năng với nướcKết luận : Trong phản ứng với nước, Clo vừa đóng vai trò là chất khử, vừa đóng vai trò là chất oxi hóa .
1.4. Trạng thái tự nhiên
Trong tự nhiên Clo có hai đồng vị bền là 35C l ( 75,77 ) 35C l ( 75,77 ) và 37C l ( 24,23 ) 37C l ( 24,23 ), nguyên tử khối trung bình là 35,5 .Clo hầu hết sống sót dưới dạng hợp chất NaCl và những chất khoáng .
1.5. Ứng dụng
Clo được dùng để tiệt trùng nước sinh họat, dùng để tẩy trắng vải, sợi giấy …Một lượng lớn Clo dùng để điều chế một số ít chất hữu cơ như : PVC, CCl4 …Điều chế 1 số ít hóa chất quan trọng khác : nước Javen
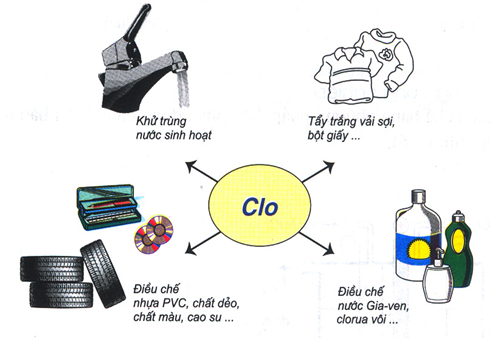
Hình 2 : Ứng dụng của Clo
1.6. Điều chế
a. Trong phòng thí nghiệmDùng chất oxihóa mạnh như MnO2, KMnO4, KClO3, … công dụng dung dịch HCl đặc hoặc muối CloruaMnO2 + 4HC l → MnCl2 + Cl2 + H2O2KM nO4 + 16HC l → 2M nCl2 + + 2KC l + 5C l2 + 8H2 O
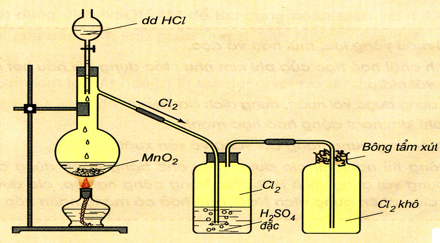
Hình 3 : Điều chế và thu khí Clo trong phòng thí nghiệmb. Trong công nghiệpĐiện phân dung dịch NaCl có màng ngăn bằng xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt .2N aCl + 2H2 O → 2N aOH + H2 + Cl2
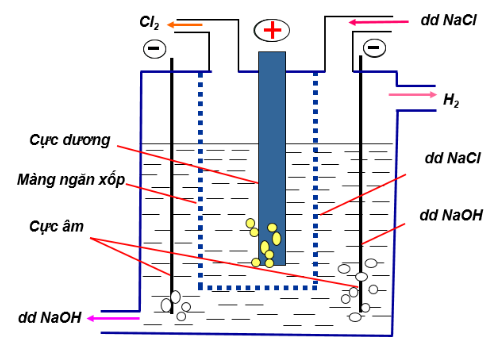
Hình 4 : Sơ đồ điện phân NaCl để thu khí Clo
1.7. Tổng kết
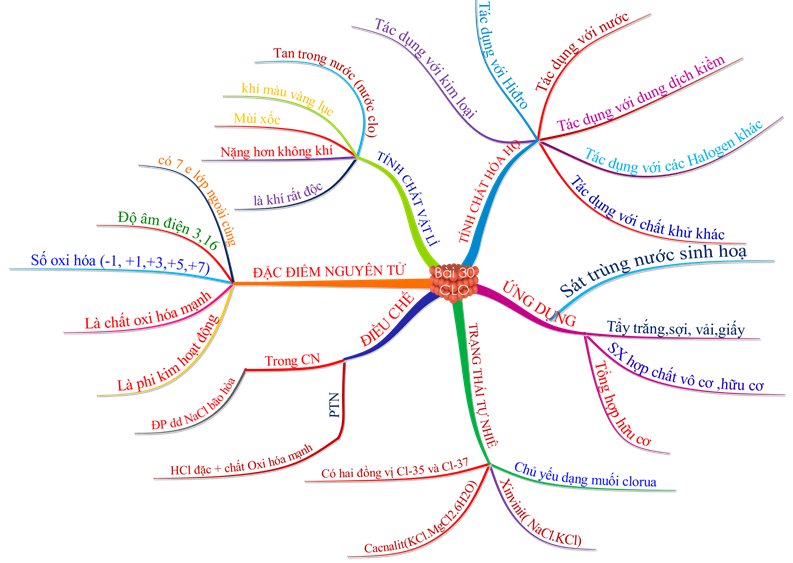
Hình 5 : Sơ đồ tư duy bài Clo
Source: https://suachuatulanh.edu.vn
Category : Tư Vấn Hỗ Trợ























































































