Sơ đồ tư duy nhóm HALOGEN trong bảng tuần hoàn hóa học, đặc điểm, tính chất
Sơ đồ Nhóm halogen gồm những nguyên tố nào? tính chất hóa học cơ bản là gì. Nguyên nhân nào làm cho các halogen có sự giống nhau về tính chất cũng như sự biến đổi có quy luật, tính chất và hợp chất của chúng ra sao mời các bạn và các em học sinh cùng tìm hiểu với chúng tôi ở bài viết dưới đây :
TÓM TẮT LÝ THUYẾT VỀ HALOGEN
1. Halogen là gì ?
Halogen là những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn hóa học, thường thì gọi là nhóm halogen hay những nguyên tố halogen .
Nhóm này gồm những nguyên tố hóa học như : Flo ( F ), Clo ( Cl ), Brôm ( Br ), Iốt ( I ), Astatin ( At là nguyên tố phóng xạ, hiếm gặp tự nhiên trong lớp vỏ Trái Đất ), Tennessine ( Ts là nguyên tố mới được phát hiện ) .
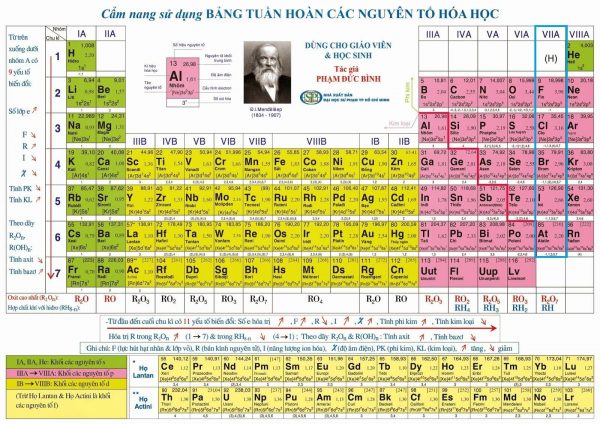
2. Cấu tạo phân tử của nhóm halogen
– Lớp electron ngoài cùng của nguyên tử những nguyên tố halogen đều có 7 electron, được phân thành hai phân lớp ( phân lớp s có 2 electron, phân lớp p có 5 electron ) .
– Do có 7 electron ở lớp ngoài cùng, chỉ còn thiếu 1 electron là đạt được thông số kỹ thuật electron bền như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp ch2. Cấu tạo phân tử của nhóm halogen
– Liên kết của phân tử ( X_ { 2 } ) không bền lắm, chúng dễ bị tách thành hai nguyên tử X. Trong phản ứng hoá học, những nguyên tử này dễ thu thêm 1 electron, do đó đặc thù hoá học cơ bản của những halogen là tính oxi hoá mạnh .
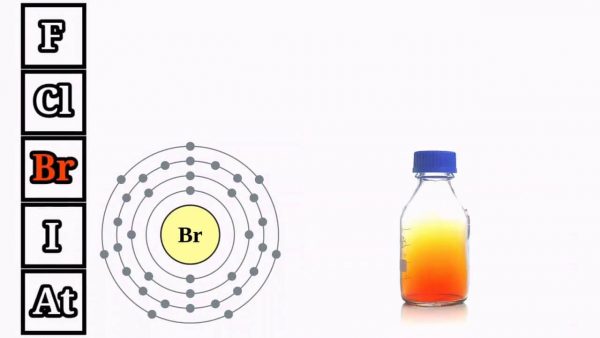
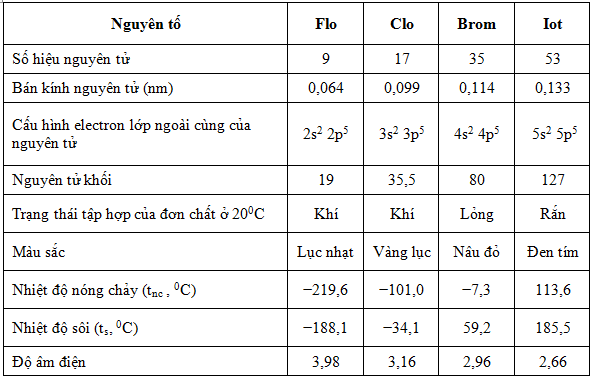
. 3. Những đặc thù vật lý của halogen
– Trạng thái và sắc tố
Chuyển từ khí sang lỏng và rắn với sắc tố đậm dần như sau : Flo ở dạng khí và có màu lục nhạt, Clo trạng thái khí có màu vàng lục, Brom dạng lỏng với màu đỏ nâu và Iốt ở trạng thái rắn có màu đen tím cùng dễ thăng hoa .
– Nhiệt độ nóng chảy, nhiệt độ sôi
Tăng dần từ flo đến iốt .
– Đặc điểm tan trong nước
Ngoài flo không tan trong nước, những chất còn lại tan tương đối ít và hầu hết tan nhiều trong 1 số ít dung môi hữu cơ .
– Trong tự nhiên chỉ sống sót ở dạng hợp chất
Clo đa phần ở dạng muối clorua, Flo thường ở trong khoáng vật florit và criolit, Brom hầu hết trong muối bromua của kali, natri và magie, iốt có trong mô một số ít loại rong biển và tuyến giáp con người …
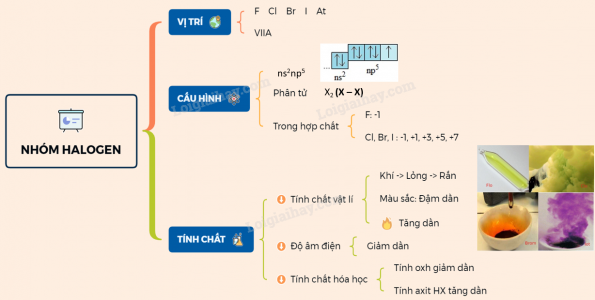
4. Sự biến đổi đặc thù hóa học của những đơn chất
– Do những halogen có lớp electron ngoài cũng có cấu trúc tựa như nhau nên những đơn chất của haogen
giống nhau về đặc thù hóa học cũng như thành phần và đặc thù của những hợp chất do chúng tạo
thành
– Tính oxi hóa giảm dần từ flo đến iot
– Đơn chất halogen oxi hóa được hầu hết những sắt kẽm kim loại tạo ra muối halogen, oxi hóa khí hiđro tạo ra
những hợp chất khí không màu, chất khí này tan trong nược tạo dung dịch axit halogenhidric .
5. Một số phản ứng minh họa tính chất của halogen
Tác dụng với sắt kẽm kim loại
– Các halogen phản ứng với hầu hết những kim loại trừ Au và Pt ( riêng F2 phản ứng được với toàn bộ những sắt kẽm kim loại ) → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao .
2M + nX2 → 2MX n
– Muối thu được thường ứng với mức hóa trị cao nhất của sắt kẽm kim loại. Riêng phản ứng của Fe với I2 chỉ tạo loại sản phẩm là FeI2 .
Phản ứng với hiđro
– Halogen phản ứng với hidro tạo thành hidro halogenua
H2 + X2 → 2HX
Với điều kiện kèm theo :
– F2 : Phản ứng được ngay cả trong bóng tối .
– Cl2 : Chỉ phản ứng khi được chiếu sáng .
– Br2 : Phản ứng xảy ra khi được đun nóng ở nhiệt độ cao .
– I2 : Là phản ứng có tính thuận nghịch và phải được đun nóng .
Tác dụng với nước
– F2 tính năng mãnh liệt với nước qua phương trình sau :
2H2 O + 2F2 → 4HF + O2
– Br2 và Cl2 có phản ứng thuận nghịch với nước :
H2O + X2 ↔ HX + HXO ( axit halogen hiđric và axit hipohalogenơ )
H2O + Cl2 ↔ HCl + HClO
– I2 không phản ứng với nước .
Phản ứng với dung dịch kiềm
– Dung dịch kiềm loãng nguội :
X2 + 2N aOH → NaX + NaXO + H2O
Cl2 + 2N aOH → NaCl + NaClO + H2O
2C l2 + 2C a ( OH ) 2 dung dịch → CaCl2 + Ca ( ClO ) 2 + 2H2 O
Cl2 + Ca ( OH ) 2 bột → CaOCl2 + H2O
– Riêng F2 :
2F2 + 2N aOH → 2N aF + H2O + OF2
– Dung dịch kiềm đặc nóng :
3X2 + 6KOH → 5KX + KXO3 + 3H2 O
3C l2 + 6KOH → 5KC l + KClO3 + 3H2 O ( 1000C )
Tác dụng với dung dịch muối halogenua
X2 + 2N aX ’ → 2N aX + X ’ 2
(Trong đó X’ là halogen có tính oxi hóa yếu hơn tính oxi hóa của halogen X. F2 không có phản ứng này).
Xem thêm : Nước là gì ? công thức hóa học của nước, cấu trúc của nước
Cấu hình khí hiếm là gì, đặc thù và công dụng của khí hiếm
Cấu hình Electron của nguyên tử, đặc thù và thứ tự của nguyên tử
Source: https://suachuatulanh.edu.vn
Category : Tư Vấn Hỗ Trợ























































































